La enfermedad pulmonar obstructiva crónica (EPOC) es un cuadro que afecta tanto a nivel respiratorio como a nivel sistémico, con una clínica de disnea, expectoración y tos. Es una enfermedad de causa multifactorial, para cuyo diagnóstico es fundamental demostrar mediante espirometría una limitación al flujo aéreo que no revierte de forma completa tras la broncodilatación inhalada, establecido por un cociente FEV1/FVC menor del 70%. Una vez diagnosticada la enfermedad, contamos con la guía GOLD y la GesEPOC para establecer el estadio de gravedad de la enfermedad que nos permita elegir el tratamiento adecuado. El tratamiento no farmacológico es importante y contempla el uso de oxigenoterapia, ventilación no invasiva, rehabilitación respiratoria y trasplante pulmonar en los casos en los que esté indicado. Durante las exacerbaciones graves hay que considerar la posibilidad de emplear un soporte respiratorio invasivo o no invasivo, en función de la situación clínica y gasométrica.
Palabras clave
Chronic obstructive pulmonary disease (COPD) is an illness which affects patients respiratorily and systemically, causing symptoms of dyspnea, expectoration, and cough. It is a disease with a multifactorial cause. For its diagnosis, it is essential to demonstrate a limitation in airflow via spirometry that does not fully revert after using inhaled bronchodilators, established as a FEV1/FVC ratio of less than 70%. Once the disease is diagnosed, the GOLD and GesEPOC guidelines are available for establishing disease severity, which allows for choosing the appropriate treatment. Non-pharmacological treatment is important and includes the use of oxygen therapy, non-invasive ventilation, respiratory rehabilitation, and lung transplantation in cases in which it is indicated. During severe exacerbations, the possibility of invasive or non-invasive respiratory support must be considered based on the clinical and blood gas situation.
Keywords
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por síntomas respiratorios persistentes y una limitación al flujo aéreo. Es debida a alteraciones alveolares y de la vía aérea que suelen estar producidas por la exposición a partículas o gases nocivos. Se trata de una enfermedad frecuente que se puede prevenir y tratar1. La EPOC se define en base a la limitación al flujo aéreo demostrada mediante la espirometría (volumen espiratorio forzado en el primer segundo/capacidad vital forzada —FEV1/FVC— menor del 70%). Sin embargo, en la práctica va a ser el impacto de los síntomas en la situación funcional del paciente el que marcará la necesidad del paciente de consultar con el médico. De esta manera, los pacientes van a buscar atención médica ya sea por los síntomas crónicos o por una exacerbación aguda, hechos que hacen que siga existiendo un importante infradiagnóstico.
EtiopatogeniaLos factores etiológicos implicados en el desarrollo de la EPOC son los siguientes2:
- 1.
Tabaquismo, sin duda el factor etiológico principal.
- 2.
Contaminación aérea de espacios cerrados (combustibles de biomasa, como la madera, para cocinar o como calefacción en países en vías de desarrollo), exposición ocupacional a partículas inhaladas y contaminación ambiental.
- 3.
Factores genéticos, entre los que destaca el déficit de alfa 1 antitripsina (AAT).
- 4.
Crecimiento y desarrollo pulmonar; prematuridad, bajo peso al nacer, infecciones respiratorias en la infancia y cualquier factor que pueda afectar al correcto desarrollo pulmonar.
- 5.
Asma e hiperreactividad bronquial.
- 6.
Estatus socioeconómico bajo.
- 7.
Los mecanismos principales implicados en la patogenia de la EPOC son tres: la inflamación crónica de las vías respiratorias, la destrucción gradual de los alvéolos y la lesión vascular pulmonar. Revisamos la situación de las vías aéreas, el parénquima pulmonar y los vasos en la patogenia de la EPOC.
Es frecuente observar un exceso de moco intraluminal, un cierto grado de edema inflamatorio y un incremento del músculo liso. En formas evolucionadas, no es infrecuente encontrar atrofia del cartílago traqueobronquial que, favoreciendo una mayor colapsabilidad, puede influir en la reducción de los flujos, especialmente durante la maniobra espiratoria forzada.
La limitación al flujo aéreo característica de los pacientes con EPOC se localiza distalmente en las vías aéreas que presentan un diámetro inferior a 2mm. En los hallazgos observados en autopsias y material quirúrgico destaca la presencia de metaplasia escamosa y de células caliciformes, cambios inflamatorios, fibrosis y un aumento del músculo liso. De forma característica se ha observado un incremento de linfocitos T (fundamentalmente CD8+), macrófagos y, en fases avanzadas, neutrófilos. Las células inflamatorias liberan diversos mediadores (leucotrieno B4, interleucina 8, factor de necrosis tumoral alfa —TNF-alfa—, etc.) que perpetúan la respuesta inflamatoria. Como consecuencia de esta respuesta inflamatoria, se produce una liberación de proteasas, edema y estrés oxidativo que originan cambios irreversibles en las vías aéreas. Las alteraciones patológicas en las vías aéreas inducen disfunción mucociliar, cuyo resultado es una disminución del transporte mucociliar, lesión del epitelio e hipersecreción de moco, lo que puede favorecer la colonización bacteriana y la aparición de exacerbaciones. Además de los cambios patológicos previos que reducen el calibre de la vía aérea, puede asociarse contracción del músculo liso, aumento del tono colinérgico e hiperrespuesta bronquial que contribuyen a agravar la obstrucción.
Parénquima pulmonarLos cambios destructivos del parénquima pulmonar asociados a la EPOC se denominan enfisema pulmonar. Desde el punto de vista clínico, en la EPOC es necesario resaltar dos entidades, el enfisema centroacinar (EC) y el enfisema panacinar (EP). El EC clásicamente se ha asociado al enfisema sintomático del fumador, siendo las lesiones más frecuentes y graves en las regiones superiores del pulmón. Por el contrario, en el EP, el ácino está agrandado de forma uniforme, perdiéndose de forma progresiva el aspecto ordenado que presenta el tejido respiratorio. Esta forma suele predominar en las regiones inferiores del pulmón, siendo característica de los pacientes con déficit de AAT. Por otro lado, no es infrecuente observar lesiones mixtas en un mismo paciente.
Cambios vasculares pulmonaresEn la EPOC encontramos alteraciones a nivel vascular pulmonar que frecuentemente conducen a hipertensión pulmonar e insuficiencia cardíaca derecha. Estas lesiones tienen un origen multifactorial, siendo especialmente relevantes la pérdida de vasos que acompaña a la destrucción enfisematosa del parénquima, la vasoconstricción pulmonar hipóxica y el remodelado vascular.
Manifestaciones clínicasDisneaLa disnea, crónica y progresiva, es el síntoma más característico de la EPOC. Se trata de la causa más importante de discapacidad y ansiedad asociada a la enfermedad. Los pacientes típicos de EPOC describen la disnea como una sensación de tener que esforzarse más para respirar, pesadez torácica, ansia de aire o jadeo/gasping. Además, los términos usados para describir la disnea varían en función de la cultura y el vocabulario de cada persona.
Tos crónicaEs, con frecuencia, el primer síntoma de la EPOC y el propio paciente suele asociarla al tabaquismo o a la exposición ambiental, siendo necesario realizar un adecuado diagnóstico diferencial (tabla 1). En un principio se puede tratar de una tos intermitente, pero finalmente acabará existiendo a diario y a lo largo de todo el día. Esta tos crónica puede ser productiva o no. La tos productiva de esputo se encuentra presente en el 30% de los pacientes. En algunos casos, la limitación significativa al flujo aéreo puede desarrollarse sin producir tos.
Diagnóstico diferencial de la tos crónica
| Otras causas de tos crónica |
| Intratorácicas |
| Asma |
| Cáncer de pulmón |
| Tuberculosis |
| Bronquiectasias |
| Insuficiencia cardíaca izquierda |
| Enfermedades intersticiales pulmonares |
| Fibrosis quística |
| Tos idiopática |
| Extratorácicas |
| Rinitis alérgica crónica |
| Síndrome de goteo postnasal |
| Síndrome de tos de vía aérea superior |
| Reflujo gastroesofágico |
| Medicación (como IECA) |
IECA: inhibidores de la enzima de conversión de la angiotensina.
Estos dos síntomas pueden variar de un día a otro y pueden preceder en años al desarrollo de la limitación al flujo aéreo.
La limitación significativa al flujo aéreo también puede estar presente sin necesidad de que haya disnea crónica y/o tos productiva y viceversa.
ExpectoraciónLa producción habitual de esputo durante 3 o más meses, en dos o más años consecutivos (en ausencia de cualquier otra causa que lo explique) constituye la definición clásica de bronquitis crónica, pero es una definición arbitraria que no refleja por completo el patrón de producción de esputo que tiene lugar en la EPOC. La producción de esputo puede ser intermitente y agravarse en las exacerbaciones.
Sibilancias y opresión torácicaSon síntomas que varían de un día a otro, así como a lo largo de un mismo día. La opresión torácica se asocia al trabajo respiratorio, está mal localizada, es de carácter muscular y se debe a la contracción isométrica de los músculos intercostales. La ausencia de sibilancias o de opresión torácica no excluye el diagnóstico de EPOC, ni tampoco la presencia de dichos síntomas confirma el diagnóstico de asma.
Características adicionales en la enfermedad graveAstenia, pérdida ponderal, pérdida de masa muscular y anorexia son problemas comunes en pacientes con EPOC grave y muy grave. Tienen importancia pronóstica y pueden ser también signo de otras enfermedades concomitantes como tuberculosis o neoplasia pulmonar, por lo que deben investigarse siempre. El síncope durante la tos ocurre por un aumento súbito de presión intratorácica durante accesos de tos prolongados. Los accesos de tos también pueden causar fracturas costales, a veces asintomáticas. El edema en los miembros inferiores es indicador de la presencia de cor pulmonale. Síntomas depresivos/ansiedad merecen una atención especial cuando se recoja la anamnesis de estos pacientes, porque son muy comunes en la EPOC y están asociados a un peor estado de salud y un aumento del riesgo de exacerbaciones y de ingreso en urgencias hospitalarias.
ComplicacionesLimitación al flujo aéreo y atrapamiento aéreoLa extensión de la inflamación, la fibrosis y los exudados intraluminales se correlacionan con la reducción del FEV1 y del cociente FEV1/FVC, así como probablemente con la aceleración del descenso del FEV1 característico de la EPOC. Esta limitación de la vía aérea periférica va atrapando aire progresivamente durante la espiración, produciéndose la hiperinsuflación. La hiperinsuflación estática reduce la capacidad inspiratoria de los pacientes y suele estar asociada con hiperinsuflación dinámica durante el ejercicio, llevando a un aumento de la disnea y constituyendo el mecanismo principal de la disnea de esfuerzo. Los broncodilatadores actúan en la vía aérea periférica reduciendo el atrapamiento aéreo, así como los volúmenes pulmonares y, por tanto, reduciendo los síntomas y mejorando la capacidad de ejercicio.
Alteración en el intercambio gaseosoLas alteraciones en el intercambio gaseoso ocasionan hipoxemia e hipercapnia. En general, el intercambio gaseoso entre O2 y CO2 empeora a medida que evoluciona la enfermedad. Esto se debe al aumento del esfuerzo que deben realizar los pacientes para vencer la limitación al flujo aéreo, junto con la discapacidad progresiva de los músculos respiratorios. La reducción del impulso ventilatorio y el aumento del espacio muerto anatómico también contribuye a la disminución de la ventilación. Las alteraciones de la ventilación alveolar y la disminución del lecho vascular pulmonar empeoran el desequilibrio del gradiente V/Q.
Hipersecreción mucosaProduce tos crónica, es un condicionante de bronquitis crónica y no se asocia necesariamente con una limitación del flujo aéreo. Cuando aparece, se debe más bien a un aumento de las células caliciformes y de las glándulas submucosas, debido a la irritación crónica de la vía aérea por el humo del tabaco y otros agentes nocivos.
Hipertensión pulmonarSe puede desarrollar en las fases finales de la enfermedad y se debe principalmente a la vasoconstricción de las arteriolas pulmonares, con el resultado de cambios estructurales que incluyen la hiperplasia de la íntima y la posterior hipertrofia/hiperplasia del músculo liso. Incluso en la EPOC moderada o en pacientes fumadores susceptibles de ser enfisematosos, existen alteraciones significativas en el flujo sanguíneo de la microvasculatura pulmonar que acelera la progresión de la enfermedad. En la EPOC se observa una respuesta inflamatoria vascular similar a la que se produce en la vía aérea, a expensas de una disfunción de las células endoteliales. La pérdida del lecho capilar pulmonar en el enfisema puede contribuir al aumento de la presión en la circulación pulmonar. La hipertensión pulmonar progresiva acaba derivando en hipertrofia ventricular derecha, así como en insuficiencia cardíaca derecha (cor pulmonale).
ExacerbacionesLas exacerbaciones de los síntomas respiratorios desencadenadas por infecciones bacterianas o víricas, por la polución ambiental o por otros factores desconocidos son muy frecuentes en los pacientes con EPOC. Durante los episodios de infecciones tiene lugar una respuesta inflamatoria muy característica, en la que se incrementa la hiperinsuflación y el atrapamiento aéreo con reducción del flujo espiratorio y, por tanto, aumentando la disnea. También se produce un empeoramiento del desequilibrio V/Q que puede desencadenar hipoxemia. Otras situaciones como la neumonía, el tromboembolismo pulmonar (TEP) y la insuficiencia cardíaca aguda pueden simular o agravar una exacerbación de la EPOC.
Afectación sistémicaLa mayoría de los pacientes con EPOC tienen enfermedades crónicas concomitantes ligadas a unos mismos factores de riesgo (tabaquismo, edad, sedentarismo, etc.) que ejercen un mayor impacto en la supervivencia y su estado de salud. La limitación al flujo aéreo y, en especial, la hiperinsuflación, afectan a la función cardíaca y al intercambio gaseoso. Los mediadores inflamatorios en la circulación contribuyen al desgaste musculoesquelético y conducen a la caquexia. Dichos mediadores inflamatorios también son los que inician o empeoran las comorbilidades como la cardiopatía isquémica, la insuficiencia cardíaca, la osteoporosis, la anemia normocítica, la diabetes y el síndrome metabólico.
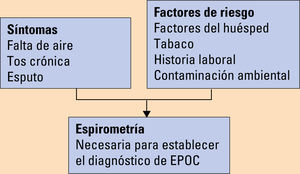
DiagnósticoEl diagnóstico de la EPOC debe sospecharse en cualquier paciente con disnea, tos crónica o expectoración, junto con historia de exposición a factores de riesgo (tabaco). Se requiere disponer de una espirometría en situación clínica de estabilidad para el diagnóstico que muestre la existencia de un cociente FEV1/FVC menor del 70% tras la broncodilatación (fig. 1). Sin embargo, hay que tener en cuenta que este valor puede infraestimar la obstrucción en sujetos jóvenes y sobrediagnosticar a los de edad más avanzada, ya que este cociente desciende fisiológicamente con el envejecimiento.
La primera vez que se realiza el diagnóstico de EPOC es obligado efectuar la determinación de la AAT o un estudio genético de la misma, para descartar un enfisema por déficit de esta proteína.
El proceso diagnóstico está formado por la anamnesis dirigida, la exploración física y la espirometría.
Anamnesis dirigidaEnfocada a detectar:
- 1.
Exposición a factores de riesgo, historia laboral, tabaquismo, exposición ambiental, etc.
- 2.
Antecedentes personales: asma, alergia, sinusitis, pólipos nasales, infecciones producidas en la infancia y otras enfermedades crónicas.
- 3.
Historia familiar de EPOC y otras enfermedades respiratorias.
- 4.
Patrón de desarrollo de los síntomas de la EPOC.
- 5.
Historia de exacerbaciones previas u hospitalizaciones por problemas respiratorios.
- 6.
Comorbilidades que puedan contribuir a la restricción de la actividad del paciente: enfermedad cardíaca, osteoporosis, enfermedades muscoloesqueléticas y enfermedad neoplásica.
- 7.
Impacto de la enfermedad en la vida del paciente, incluyendo limitación de la actividad, ausencia laboral e impacto económico, influencia en la vida familiar, depresión o ansiedad, bienestar y actividad sexual.
- 8.
Apoyo social y familiar del que dispone el paciente.
- 9.
Posibilidad de reducir los factores de riesgo, en especial el abandono del hábito tabáquico.
No suele ser diagnóstica de EPOC, pero es una parte muy importante de la atención sanitaria del paciente. Los signos físicos de obstrucción al flujo aéreo no suelen aparecer hasta que existe una reducción significativa de la función pulmonar, por lo que la exploración física tiene una sensibilidad y una especificidad relativamente bajas a la hora de detectar la enfermedad en un principio. Podemos encontrar numerosos signos físicos en la EPOC (cianosis central o palidez de las mucosas; alteraciones de la caja torácica como el tórax en tonel o la horizontalización de las costillas; bajo peso o inclulo caquexia; respiración con labios fruncidos y uso de musculatura respiratoria accesoria), pero su ausencia no excluye el diagnóstico.
EspirometríaEs la forma más objetiva y reproducible de medir la obstrucción al flujo aéreo. Es una prueba no invasiva y ampliamente disponible. En cualquier centro sanitario, en especial en Atención Primaria, debe existir la posibilidad de realizar espirometrías de calidad.
Con la espirometría se mide el volumen espiratorio forzado desde el punto de inspiración máxima (FVC) y el volumen de aire espirado durante el primer segundo de la maniobra (FEV1), así como el cociente entre ambos parámetros (FEV1/FVC). Los valores de la espirometría son comparados con valores de referencia basados en la edad, el peso, el sexo y la raza. Mientras que la espirometría post-broncodilatación es necesaria para diagnosticar y evaluar la EPOC, evaluar el grado de reversibilidad de la obstrucción al flujo aéreo tras la broncodilatación ya no está recomendado para guiar las decisiones terapéuticas.
El papel de la espirometría para hacer cribado de la población general puede generar controversia. Actualmente, se recomienda buscar casos activos, como por ejemplo realizando una espirometría a pacientes con síntomas o con factores de riesgo, pero no como cribado a la población en general. La búsqueda sistemática de casos activos a nivel de Atención Primaria mediante el envío de un correo electrónico con un cuestionario ha demostrado ser efectiva para identificar casos no diagnosticados de EPOC.
Estratificación del riesgoUna vez realizado el diagnóstico, se debe evaluar el nivel de riesgo. Como tal se entiende la probabilidad de que el paciente pueda presentar agudizaciones, progresión de la enfermedad, futuras complicaciones, consumo de recursos sanitarios o mayor mortalidad.
Los factores considerados para la evaluación del riesgo son:
- 1.
El grado de obstrucción medido por el FEV1 (%) post-broncodilatador.
- 2.
El nivel de disnea medido por la escala modificada del Medical Research Council (mMRC).
- 3.
El riesgo de exacerbaciones.
- 4.
La presencia de comorbilidades.
Los componentes de esta clasificación de riesgo tienen poder predictivo sobre la mortalidad. La inclusión del FEV1 ha mostrado añadir valor predictivo de forma significativa a la clasificación de riesgo, y estudios recientes han evidenciado la adecuación de la clasificación de riesgo a la realidad asistencial y su aportación en la selección del tratamiento farmacológico. A mayor nivel de riesgo, mayor necesidad de intervenciones terapéuticas.
Grado de obstrucción al flujo aéreo medido por FEV1 post-broncodilatadorEn la tabla 2 se recoge la clasificación de la gravedad de la obstrucción.
Clasificación de la enfermedad pulmonar obstructiva crónica (EPOC) en función del grado de obstrucción
| Clasificación de la gravedad de la limitación al flujo aéreo en la EPOC (basado en el FEV1post-broncodilatación) | ||
| En pacientes con FEV1/FVC<70 | ||
| GOLD 1: | Leve | FEV1≥80% predicho |
| GOLD 2: | Moderada | FEV1 del 50% al 80% del predicho |
| GOLD 3: | Grave | FEV1 entre 30% y el 50% del predicho |
| GOLD 4: | Muy grave | FEV1<30% predicho |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada.
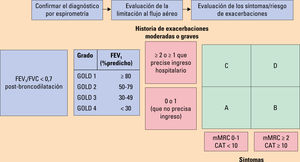
Existe una relación débil entre el FEV1, los síntomas y el deterioro del estado de salud de un paciente, por ello se necesita evaluar formalmente los síntomas que presenta cada paciente. La disnea medida mediante una escala simple como es la mMRC presenta una adecuada correlación con el estado de salud del paciente y predice el riesgo de mortalidad de este. La disnea se complementa con escalas sencillas como el COPD assessment test (CAT) que mide el impacto que la EPOC está teniendo en el bienestar y la vida diaria del paciente (figs. 2 y 3).
En estudios clínicos se recomienda usar también escalas más completas de síntomas, aparte de solo la disnea como son el Chronic Respiratory Questionare (CRQ) y el St. George's Respiratory Quetsionaire (SGRQ).
Riesgo de exacerbacionesLas exacerbaciones se pueden clasificar en:
- 1.
Leves (solo se tratan con broncodilatadores).
- 2.
Moderadas (con broncodilatadores, antibióticos y corticosteroides orales.
- 3.
Graves, en las que el paciente requiere consultar en urgencias u hospitalización y pueden ir acompañadas de insuficiencia respiratoria aguda.
Además, el deterioro de la limitación al flujo aéreo se relaciona con un incremento en la prevalencia de exacerbaciones, ingresos hospitalarios y riesgo de muerte. También existe relación significativa entre la gravedad de la espirometría y el riesgo de exacerbaciones y muerte.
Evaluación de las comorbilidadesEs frecuente que en la EPOC coexista enfermedad cardiovascular, disfunción musculoesquelética, síndrome metabólico, osteoporosis, depresión, ansiedad y cáncer de pulmón. La existencia de EPOC aumenta el riesgo de otras enfermedades, incidiendo en concreto en el cáncer de pulmón. Por un lado, esta asociación se debe a los factores de riesgo que ambas tienen en común (tabaco), pero aún no queda claro si tiene influencia la susceptibilidad genética o un peor aclaramiento de los carcinógenos.
Las comorbilidades pueden darse tanto en los casos leves como en los moderados y graves de EPOC. Influyen de forma independiente en la mortalidad y los ingresos hospitalarios, por lo que merecen un tratamiento específico.
Evaluación combinada de la EPOCDadas las limitaciones de la herramienta de evaluación combinada ABCD de la GOLD, la guía GOLD ha producido un refinamiento de esta herramienta, incorporando a la escala cuatro grados espirométricos (del 1 al 4) para cada grupo A, B, C o D. El número usado aporta información acerca de la severidad de la limitación al flujo aéreo (de 1 a 4), mientras que la letra (de la A a la D) habla sobre los síntomas y el riesgo de exacerbaciones (fig. 4). Esta escala servirá para guiar el tratamiento.
El FEV1 es un parámetro muy importante a nivel poblacional a la hora de predecir eventos importantes, como la mortalidad y la hospitalización, o para decidir terapias no farmacológicas como la reducción del volumen o el trasplante pulmonar. No obstante, a nivel individual, el FEV1 pierde precisión y no puede ser usado en solitario para decidir todas las opciones de tratamiento. Por eso, gracias a este refinamiento de la herramienta ABCD, se podrán tomar decisiones en base a los síntomas y la historia de exacerbaciones en situaciones de ingreso o en la sala de urgencias sin necesidad de medir el FEV1 en ese momento.
Por otro lado, la guía GesEPOC3 propone una estratificación de la enfermedad en bajo o alto riesgo de agudizaciones, de progresión de enfermedad o de complicaciones futuras y, por lo tanto, de mayor consumo de recursos y aumento de mortalidad (tabla 3).
Estratificación de la enfermedad pulmonar obstructiva crónica (GesEPOC)
| Riesgo bajo (se deben cumplir todos los criterios) | Riesgo alto (se debe cumplir al menos un criterio de los siguientes) | |
|---|---|---|
| Obstrucción (FEV1 post-broncodilatación %) | ≥ 50% | < 50% |
| Disnea mMRC | 0-1 | 2-4 |
| Exacerbaciones (último año) | 0-1 (sin ingreso) | 2 o más o 1 con ingreso |
| Pruebas diagnósticas | Espirometría forzadaPruebas complementarias básicas: radiografía de tórax, análisis con alfa-1 antitripsina, saturación arterial del oxígeno (SaO2) | Volúmenes pulmonares, DLCO; prueba de esfuerzo: marcha 6 minutos. TAC torácica. Caracterización fenotípica. Riesgo pronóstico: BODE o BODEx |
DLCO: capacidad de difusión pulmonar; FEV1; volumen espiratorio forzado en el primer segundo; mMRC: escala modificada del Medical Research Council; TAC: tomografía axial computarizada.
La valoración del déficit de AAT (DAAT) está indicada en todos los pacientes con diagnóstico de EPOC. El clásico paciente con DAAT es joven, menor de 45 años y con EP, pero se ha visto que el retraso en el diagnóstico ha conducido a la identificación de algunos pacientes con DAAT de mayor edad y tienen EC de localización más apical.
Prueba de la marcha de 6 minutosExisten casos en los que hay discordancia entre la limitación al flujo aéreo y los síntomas referidos por el paciente. En estos casos, estaría recomendado realizar una prueba de la marcha de los 6 minutos, ya que los pacientes con EPOC limitan su actividad física para adaptarse a su condición y, por tanto, infraestimar los síntomas que padecen. Con el test de la marcha de 6 minutos se puede mostrar si el paciente está obstruido de forma grave y necesita un tratamiento más intensivo que el que sugería la evaluación inicial. Además, se utiliza para valorar la existencia de desaturación de oxígeno durante el ejercicio y la posible necesidad de utilizar oxígeno para la deambulación.
Estrategia terapéuticaLos objetivos generales del tratamiento de la EPOC se resumen en reducir los síntomas de la enfermedad, disminuir la frecuencia y gravedad de las agudizaciones y mejorar la calidad de vida y la supervivencia. Se deben alcanzar tanto los beneficios a corto plazo (control de la enfermedad) como los objetivos a medio y largo plazo (reducción del riesgo). El tratamiento de la EPOC consta de dos pilares: farmacológico y no farmacológico. Dentro del tratamiento no farmacológico se encontraría el abandono tabáquico, la correcta vacunación, la rehabilitación, la educación y el autocuidado, los cuidados paliativos y, en algunos casos, la cirugía. El tratamiento farmacológico dispone de varias opciones que se combinan entre sí en función del fenotipo de la EPOC de cada paciente y de su clase de riesgo.
Tratamiento no farmacológicoEl abandono del hábito tabáquico es clave. La utilización de bupropión, citisina y la nicotina sustitutiva tiene como resultado un aumento de la abstinencia del tabaco a largo plazo. Las prohibiciones legislativas y el asesoramiento proporcionado por profesionales de la salud incrementan las tasas de abandono.
La efectividad y la seguridad de los cigarrillos electrónicos como ayuda para abandonar el tabaco son inciertas en el momento actual y no son estrategias aconsejables.
La vacunación de la gripe y frente al neumococo disminuye la incidencia de infecciones de vía aérea inferior.
La rehabilitación pulmonar mejora los síntomas, la calidad de vida y la optimización física y emocional en las actividades de la vida diaria.
En pacientes con hipoxemia crónica grave en reposo se ha demostrado que la oxigenoterapia a largo plazo reduce la mortalidad. En pacientes con EPOC estable y desaturación moderada en reposo o inducida por el ejercicio no se debería prescribir de rutina la oxigenoterapia a largo plazo. Por tanto, son criterios de oxigenoterapia crónica domiciliaria (OCD):
- 1.
Presión arterial de oxígeno (PaO2) en reposo igual o inferior a 55mmHg.
- 2.
PaO2 en reposo entre 56-59mmHg con evidencia de daño orgánico por hipoxia (insuficiencia cardíaca derecha, hipertensión pulmonar o policitemia).
En pacientes con hipercapnia crónica grave e historia de múltiples ingresos por insuficiencia respiratoria, la ventilación no invasiva a largo plazo disminuye la mortalidad y previene los reingresos.
Administrar AAT purificada en caso de DAAT grave asociado a enfisema pulmonar.
Las intervenciones de reducción de volumen pulmonar, quirúrgicas o por broncoscopia, podrían ser beneficiosas para optimizar la asistencia médica en pacientes seleccionados con enfisema extenso refractario.
El trasplante pulmonar es otra opción de tratamiento no farmacológico.
Los cuidados paliativos son efectivos para controlar los síntomas de la EPOC avanzada.
Tratamiento farmacológicoLa terapia farmacológica puede reducir los síntomas de la EPOC, disminuir la frecuencia y gravedad de las exacerbaciones y mejorar el estado de salud y la tolerancia al ejercicio. Los datos más recientes sugieren también efectos beneficiosos en la reducción de la mortalidad.
Existen varios grupos de medicamentos disponibles para el tratamiento de la EPOC. La elección de cada clase depende de la disponibilidad y de la adecuada respuesta clínica. Cada régimen de tratamiento debe ser individualizado, ya que la relación entre la gravedad de los síntomas, la limitación al flujo aéreo y la gravedad de las exacerbaciones difiere entre cada paciente.
La base del tratamiento de la EPOC estable la constituyen los fármacos inhalados:
- 1.
Broncodilatadores de corta duración (BDCD): agonistas beta-2 adrenérgicos (SABA) y anticolinérgicos (SAMA).
- 2.
Broncodilatadores de larga duración (BDLD): agonistas beta-2 adrenérgicos (LABA) o anticolinérgicos (LAMA).
- 3.
Corticoides inhalados (CI).
Los BDLD, en monoterapia o en biterapia, son los fármacos de primera elección en la mayoría de los pacientes. Los tratamientos que se deben añadir a los BDLD en el tratamiento de inicio dependerán del grupo de riesgo y el fenotipo clínico:
- 1.
El tratamiento del fenotipo no agudizador está basado en el uso de la doble broncodilatación (LAMA+LABA).
- 2.
El tratamiento del fenotipo agudizador eosinofílico añade CI (LAMA+LABA+CI).
- 3.
El tratamiento del fenotipo agudizador no eosinofílico se basa en los BDLD. Los CI pueden ser útiles en algunos casos, aunque su eficacia es menor.
La identificación de rasgos tratables permite un tratamiento específico dirigido a las necesidades de cada paciente. El control de la EPOC es una herramienta útil para el seguimiento y la adecuación terapéutica.
Elección de tratamiento según el riesgoBajo riesgo. Se debe decidir el tratamiento guiado por síntomas. En pacientes con síntomas intermitentes y obstrucción leve puede plantearse un broncodilatador tipo SAMA o SABA a demanda, permitiendo mejorar el control sintomático y la tolerancia al esfuerzo. En aquellos pacientes con síntomas persistentes se debe iniciar BDLD. El tiotropio (LAMA) ha demostrado ser más eficaz en la prevención de agudizaciones frente a otros BDLD, por lo que es considerado de primera elección en monoterapia. En caso de persistencia de síntomas y/o limitación al esfuerzo a pesar de la monoterapia, se debe comprobar la adherencia terapéutica, adoptar una adecuada técnica inhalatoria y valorar escalar a doble terapia broncodilatadora (LAMA/lABA).
Alto riesgo. Se debe decidir el tratamiento según los distintos fenotipos (no agudizador, agudizador eosinofílico y agudizador no eosinofílico).
No agudizador. Máximo una agudización el año previo sin precisar ingreso hospitalario. Se debe optar por un tratamiento inicial con doble terapia broncodilatadora (LAMA/lABA).
Agudizador. Dos o más agudizaciones ambulatorias, o una o más agudizaciones graves que precisen atención hospitalaria el año previo, separadas por al menos cuatro semanas desde la resolución de la exacerbación previa o seis semanas desde el inicio de los síntomas, para diferenciar el nuevo evento de una recaída o de un fracaso terapéutico.
- 1.
Agudizador eosinofílico. Presenta eosinofilia periférica de más de 300 células/mm3. Se debe iniciar tratamiento con doble terapia broncodilatadora (LAMA/lABA). Se ha observado que este fenotipo presenta mejor respuesta a CI, sobre todo en aquellos pacientes con: cifras elevadas de eosinófilos; mayor frecuencia de agudizaciones y buena respuesta a corticoides sistémicos en agudizaciones previas.En caso de persistencia de síntomas y/o agudizaciones en paciente tratados con LABA/lAMA, el siguiente escalón de tratamiento debe ser la triple terapia CI/lABA/lAMA.
- 2.
Agudizador no eosinofílico. Sin eosinofilia periférica o presentan menos de 300 células/mm3. De elección se debe iniciar tratamiento con doble terapia broncodilatadora (LAMA/lABA). Este fenotipo presenta menor respuesta a CI; sin embargo, puede utilizarse en pacientes seleccionados (más de 100 eosinófilos/mm3, mayor número de agudizaciones, buena respuesta a corticoides sistémicos en agudizaciones previas y sin antecedentes de neumonía).
Estabilidad (sin exacerbaciones en los tres meses previos).
Un nivel de bajo impacto:
- 1.
Bajo nivel de disnea (FEV1 igual o superior a 50%, disnea 0-2).
- 2.
Sin expectoración o expectoración mucosa.
- 3.
Uso infrecuente de medicación de rescate (menos de 3 veces/semana).
- 4.
Un nivel adecuado de actividad física (30 o más minutos/día).
Retirada de CI en pacientes que no tengan agudizaciones frecuentes (no más de una moderada en el año previo) y menos de 300 eosinófilos/mm3.
Por otro lado, la guía GOLD propone un manejo de la EPOC estable en base al grupo de gravedad.
A continuación, se muestra un esquema para la iniciación del manejo farmacológico de la EPOC de acuerdo con la evaluación individual de los síntomas y del riesgo de exacerbaciones.
Hay una carencia de evidencia de alta calidad que apoye la estrategia de tratamiento farmacológico inicial en el diagnóstico de novo de la EPOC. De todas formas, un estudio observacional a nivel mundial ha demostrado que el tratamiento inicial de la EPOC con un LABA/CI es más efectivo que el tratamiento con un LAMA en pacientes con exacerbaciones previas y eosinófilos altos en sangre (menos de 300 cels/microl) (fig. 5).
Tratamiento farmacologico inicial de la enfermedad pulmonar obstructiva cronica (EPOC). CI: corticoides inhalados; LABA: broncodilatadores de larga duracion agonistas beta-2; LAMA: broncodilatadores de accion duracion anticolinergicos ; mMRC: escala modificada del Medical Research Council. *Considerarlo si los sintomas son muy intensos (CAT > 20). **Considerarlo si hay > 300 eosinofilos.
Los pacientes deben ser seguidos para confirmar que la terapia que se ha implementado consigue los objetivos e identificar las posibles barreras de cara a conseguir el éxito del tratamiento.
Durante el seguimiento de la respuesta del paciente al inicio del tratamiento puede ser necesario el ajuste farmacológico.
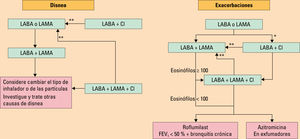
A continuación, se proporciona un algoritmo para continuar el tratamiento a largo plazo, donde el manejo aún se basa en los síntomas y en el riesgo de exacerbaciones, pero las recomendaciones ya no dependen del grupo de la GOLD al que pertenezca el paciente en el momento del diagnóstico. Con estas indicaciones, se facilita la adherencia del paciente al tratamiento, tanto al inicio como al cabo de los años. Estas recomendaciones incorporan la evidencia reciente de los ensayos clínicos y el uso de la eosinofilia en sangre periférica como biomarcador para guiar la terapia con glucocorticoides para la prevención de la exacerbación.
Con el algoritmo de la figura 6 se sugiere escalar y desescalar en la estrategia de tratamiento en función de la respuesta del paciente, así como en la seguridad.
Tratamiento farmacologico de mantenimiento de la enfermedad pulmonar obstructiva cronica (EPOC). Si la respuesta al tratamiento inicial es adecuada se mantiene el mismo tratamiento. Si no es adecuada la respuesta al tratamiento, el sintoma predominante en cada paciente (disnea o exacerbaciones) constituira la diana terapeutica que guiara la via terapeutica que se debe elegir. Si predominan ambos sintomas, se encaminara el tratamiento por la via de las exacerbaciones.. CI: corticoides inhalados; FEV1: volumen espiratorio forzado en el primer segundo; LABA: broncodilatadores de accion larga agonistas beta-2; LAMA: broncodilatadores de accion larga anticolinergicos. *Considerar si los eosinofilos son ≥ 100 y ≥ 2 exacerbaciones moderadas o un ingreso. **Considerar la bajada de escalon de CI o su cambio si hay neumonia, la indicacion inapropiada en un inicio o la falta de respuesta a los CI.
La respuesta al tratamiento siempre debe ser revisada, y se debería considerar la desescalada ante la ausencia de beneficio clínico y/o efectos adversos.
También se debería considerar la desescalada ante aquellos pacientes con EPOC que, tras el inicio del tratamiento, presentan la desaparición de algunos síntomas y que por tanto necesitan menos tratamiento.
En aquellos pacientes en los que se está considerando la modificación del tratamiento, sobre todo en la desescalada, esta debería hacerse bajo supervisión médica estrecha. De todas maneras, los esquemas de desescalada aún no están estudiados de forma sistemática, y solo se han realizado con la línea de CI. Tampoco los esquemas de escalada de tratamiento se han estudiado de forma sistemática.
Manejo de las exacerbacionesUna exacerbación de la EPOC se define como el empeoramiento agudo de los síntomas respiratorios que da como resultado el uso de un tratamiento adicional.
Requiere realizar un diagnóstico diferencial exhaustivo, ya que los síntomas son inespecíficos.
Los desencadenantes son muy numerosos, pero lo más frecuente es que se deban a infecciones respiratorias.
El objetivo principal del tratamiento de las exacerbaciones es minimizar el impacto negativo de la exacerbación y prevenir sus posibles consecuencias.
Los SABA inhalados, con o sin anticolinérgicos de acción corta (SAMA), son los broncodilatadores recomendados de inicio para el tratamiento agudo de la exacerbación.
La terapia de mantenimiento con BDLD debería iniciarse lo más pronto posible antes del alta hospitalaria.
Los CI pueden incrementar la función pulmonar (FEV1), la oxigenación y el tiempo de recuperación y de estancia hospitalaria. La duración de la terapia no debe superar los 5-7 días.
Los antibióticos, cuando estén indicados, pueden disminuir el tiempo de recuperación, reducir el riesgo de recaída precoz y fracaso terapéutico y el tiempo de hospitalización. La duración de la terapia debe ser de 5-7 días.
Las metilxantinas no están recomendadas debido al aumento de efectos adversos.
La modalidad de ventilación mecánica no invasiva (VMNI) debe ser el primer modo de ventilación empleado en los pacientes con EPOC con insuficiencia respiratoria que no tienen contraindicación absoluta, porque mejora el intercambio gaseoso, reduce el trabajo respiratorio y la necesidad de intubación, disminuye la duración de la hospitalización e incrementa la supervivencia.
Después de una exacerbación se deben iniciar medidas apropiadas para prevenir nuevas exacerbaciones.
Diagnóstico diferencial de la exacerbación de la EPOC y pruebas para distinguirlosSe realizará diagnóstico diferencial con:
- 1.
Neumonía: radiografía de tórax, proteína C reactiva o procalcitonina.
- 2.
Neumotórax: radiografía o ecografía torácicas
- 3.
Derrame pleural: radiografía o ecografía torácica.
- 4.
Tromboembolismo pulmonar: dímero D con/sin eco-Doppler de miembros inferiores o angio-TAC de arterias pulmonares protocolo TEP.
- 5.
Edemas de pulmón cardiogénico: electrocardiograma (ECG), enzimas cardíacas y ecocardiografía.
- 6.
Arritmias cardíacas o fibrilación auricular (FA) o flutter: ECG.
Las dividiremos en:
- 1.
Leve: se trata con SABA únicamente.
- 2.
Moderada: requiere SABA y antibióticos con/sin corticosteroides orales.
- 3.
Grave: el paciente requiere hospitalización o visitas a Urgencias. También pueden asociar insuficiencia respiratoria aguda. Dentro de los pacientes hospitalizados, se recomienda subclasificarlos en:
- –
Sin insuficiencia respiratoria: de 20 a 30 respiraciones por minuto. Sin uso de musculatura accesoria. Estado mental conservado. La hipoxemia mejora con mascarilla Venturi FiO2 25%-30%. Sin hipercapnia.
- –
Con insuficiencia respiratoria sin llegar a comprometer la vida: frecuencia respiratoria mayor de 30rpm. Uso de musculatura accesoria. Estado mental conservado. La hipoxemia mejora solo con mascarilla Venturi a FiO2 28%-35%. Hipercapnia elevada sobre la basal del paciente o elevada a 50-60mmHg.
- –
Con insuficiencia respiratoria aguda amenazando su vida: más de 30rpm. Uso de musculatura accesoria. Alteración cognitiva aguda. Hipoxemia que no remonta con mascarilla Venturi FiO2 mayor del 40%. Hipercapnia superior a la basal del paciente o por encima de 60mmHg o acidosis (pH menor o igual 7,25).
- –
Además, se ha visto que hay cierto número de exacerbaciones en las que el paciente no llega a solicitar atención sanitaria por ser más leves pero, sin embargo, también ejercen su impacto en la evolución de la enfermedad. Por eso es muy importante que estos pacientes reciban educación suficiente sobre su enfermedad para saber reconocer cuándo presentan síntomas de exacerbación y cuándo consultar por ello.
La mayoría de las agudizaciones están desencadenadas por infecciones víricas (rinovirus el más frecuente), aunque también se pueden producir por infecciones bacterianas o por agentes contaminantes del ambiente. La exposición de corta duración a partículas en suspensión finas (PM2.5) se asocia con más hospitalizaciones y mortalidad por EPOC.
Opciones de tratamientoDependiendo de la gravedad de la agudización o de la gravedad de la patología subyacente, una exacerbación puede ser manejada de forma ambulatoria o de forma hospitalaria. Más del 80% de las exacerbaciones son manejadas de forma ambulatoria en base a terapia farmacológica, incluyendo broncodilatación, corticosteroides y antibióticos.
Cuando el paciente con exacerbación de la EPOC llega al servicio de urgencias, debe ser provisto de oxígeno suplementario y ser sometido a una evaluación que determine si la exacerbación puede poner en riesgo su vida.
Si aumenta el trabajo respiratorio o desciende el intercambio gaseoso, se debe valorar la VMNI. De ser así, los profesionales sanitarios deberían trasladar al paciente a la unidad de cuidados intermedios respiratorios o incluso a la unidad de cuidados intensivos (UCI). Si no fuese así, el paciente podría ser tratado en el servicio de urgencias o en la planta de hospitalización.
Además de la terapia farmacológica, el manejo hospitalario incluye el soporte respiratorio con oxigenoterapia o ventilación.
Criterios de ingreso hospitalarioSon los siguientes:
- 1.
Síntomas graves como: disnea de reposo repentina, aumento de la frecuencia respiratoria, descenso de la saturación de oxígeno, confusión o somnolencia.
- 2.
Insuficiencia respiratoria aguda.
- 3.
Inicio de nuevos síntomas (como cianosis, edemas periféricos, etc.).
- 4.
Ausencia de respuesta al tratamiento farmacológico inicial.
- 5.
Existencia de comorbilidades graves (insuficiencia cardíaca, arritmias denovo, etc.).
- 6.
Apoyo sociofamiliar insuficiente.
Oxigenoterapia simple. Es un componente clave del tratamiento hospitalario de una exacerbación. Debe usarse con el objetivo de conseguir una saturación del 88% al 92%. Cuando se inicia la oxigenoterapia, hay que ir revisando los gases sanguíneos periódicamente para asegurar una correcta oxigenación sin que aparezca retención de CO2 o acidosis. Existen estudios que demuestran que la gasometría venosa para evaluar los niveles de bicarbonato y el pH sanguíneo es precisa en comparación con la gasometría arterial (si se asegura un rápido procesamiento). Las mascarillas Venturi aseguran una oxigenación más controlada que la que se proporciona por gafas nasales.
Terapia de alto flujo nasal. Con las gafas nasales de alto flujo se proporciona oxígeno humidificado y caliente mezclado, mediante aparatos especiales en rangos superiores a 8 l/min en niños y 60 l/min en adultos. Esta terapia se ha asociado con una mejoría de la oxigenación y la ventilación, un descenso de la hipercapnia y una mejoría de la calidad de vida en relación con la salud en pacientes con hipercapnia aguda durante una exacerbación y también en pacientes con hipercapnia estable por su EPOC.
Soporte ventilatorio. Algunos pacientes necesitan el ingreso directo en la unidad de cuidados intermedios respiratorios o en la UCI. Para ello se requiere personal entrenado y un equipamiento adecuado para identificar y tratar la insuficiencia respiratoria aguda. El soporte respiratorio se puede aportar mediante ventilación invasiva (intubación orotraqueal o traqueostomía) o no invasiva (mascarilla nasal o facial). Los estimulantes respiratorios no están indicados para la insuficiencia respiratoria aguda.
Ventilación mecánica no invasiva. El uso de VMNI es preferible frente a la ventilación invasiva (intubación y ventilación con presión positiva) a la hora de tratar la insuficiencia respiratoria aguda en pacientes ingresados por agudización de la EPOC. En estudios recientes se ha demostrado un resultado exitoso de la VMNI del 80%-85%. Ha confirmado mejorar la oxigenación y la acidosis respiratoria aguda, ya que aumenta el pH y desciende el CO2. También ayuda a disminuir la frecuencia respiratoria, el trabajo respiratorio y la severidad de la sensación de falta de aire, así como disminuye las complicaciones asociadas a la ventilación mecánica invasiva (VMI) como son la neumonía asociada a la ventilación y la duración del ingreso hospitalario. Más importante aún, la tasa de intubación y de mortalidad se reduce mediante la VMNI. Una vez que los pacientes mejoran y consiguen tolerar 4 horas de respiración no asistida, la VMNI puede ser retirada directamente sin la necesidad de un período de «destete».
Ventilación mecánica invasiva. Estaría indicada en situaciones como el fracaso de la VMNI, la intolerancia a esta, la disminución del nivel de consciencia, la agitación psicomotriz, la broncoaspiración masiva, la incapacidad de manejar las secreciones, la inestabilidad hemodinámica severa, las arritmias graves, etc.
Criterios de indicación de la ventilación mecánica no invasiva. Acidosis respiratoria (PaCO2 igual o superior a 45mmHg y pH arterial igual o inferior a 7,35).
Disnea severa con signos clínicos sugestivos de fatiga de los músculos respiratorios, aumento del trabajo respiratorio o ambos, como son el uso de musculatura respiratoria accesoria, movimientos paradójicos abdominales o restricción de los espacios intercostales.
Criterios de ingreso en la unidad de cuidados intensivos o en la unidad de cuidados intermedios respiratorios. Los criterios de ingreso son:
- 1.
Disnea severa que no responde adecuadamente a la terapia inicial en urgencias.
- 2.
Cambios en el nivel de consciencia (confusión, letargia, coma, etc.).
- 3.
Hipoxemia persistente o tendente a empeorar (PaO2 menor de 40mmHg) y/o acidosis respiratoria grave o empeorando (pH 7.25) a pesar de suplementación de oxígeno o VMNI.
- 4.
Necesidad de VMI.
- 5.
Inestabilidad hemodinámica o necesidad de vasopresores.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
-
 Importante
Importante
-
 Muy importante
Muy importante
-
 Metaanálisis
Metaanálisis
-
 Ensayo clínico controlado
Ensayo clínico controlado
-
 Epidemiología
Epidemiología
-
 Artículo de revisión
Artículo de revisión
-
 Guía de práctica clínica
Guía de práctica clínica