El asma es una enfermedad inflamatoria crónica de las vías respiratorias con múltiples factores de riesgo implicados en su patogenia y que se caracteriza clínicamente por disnea, tos y sibilancias.
Para su diagnóstico, la clínica y la función respiratoria son las herramientas clave (espirometría con obstrucción, reversibilidad, variabilidad, óxido nítrico en aire espirado —FENO— y provocación bronquial). El tratamiento del asma tiene como finalidad el control de la enfermedad, manteniendo estables síntomas y exacerbaciones. Para implantar un adecuado tratamiento, el asma se clasifica según su gravedad y, en función de esta, se sigue el algoritmo terapéutico de 6 escalones publicado en la guía española GEMA. El pilar terapéutico fundamental son los corticoides inhalados presentes en cada uno de los escalones, asociados a otros fármacos para el control de la enfermedad (agonistas beta 2, antimuscarínicos, antagonistas de los leucotrienos). En estos últimos años, destaca la incorporación al arsenal terapéutico de los anticuerpos monoclonales para el tratamiento del asma grave alérgica y eosinofílica.
Palabras clave
Asthma is a chronic inflammatory disease of the respiratory tract with multiple risk factors involved in its pathogenesis. It is clinically characterized by dyspnea, cough, and wheezing.
Symptoms and respiratory function are the key tools for diagnosing it (spirometry with obstruction, reversibility, variability, fractional exhaled nitric oxide —FENO—, bronchial provocation). The goals of asthma treatment are disease control and maintaining symptoms and exacerbations stable. In order to implement a suitable treatment, asthma is classified according to its severity and based on that, the six-step treatment algorithm indicated in the Spanish GEMA guidelines is followed. The fundamental pillar of therapy is inhaled corticosteroids, which is present in each of the steps, and other drugs are associated for disease control (beta2-agonists, muscarinic receptor antagonists, leukotriene receptor antagonists). In recent years, the incorporation of monoclonal antibodies into the treatment arsenal for severe allergic and eosinophilic asthma is noteworthy.
Keywords
La Guía Española para el Manejo del Asma (GEMA) define el asma como una enfermedad inflamatoria crónica de las vías respiratorias, en la que participan distintas células y mediadores de la inflamación, condicionada en parte por factores genéticos, que cursa con hiperrespuesta bronquial y una obstrucción variable al flujo aéreo, total o parcialmente reversible, ya sea por la acción medicamentosa o espontáneamente1.
Se define por la historia de síntomas respiratorios como sibilancias, dificultad respiratoria, opresión torácica y tos, acompañada de una limitación variable del flujo aéreo2. Al ser una enfermedad crónica, el objetivo de su abordaje es alcanzar y mantener el control de los síntomas y la prevención del riesgo futuro, especialmente de las exacerbaciones1.
EpidemiologíaEl asma es una enfermedad que afecta a más de 300 millones de personas en el mundo, y se estima que para el año 2025 aumente esta cifra a 400 millones; esto es debido al incremento en la contaminación ambiental, principalmente en zonas industrializadas3. El estudio del Global Burden of Disease ha mostrado que la prevalencia del asma ha aumentado en todo el mundo, desde 1990 a 2015, en un 12,6%. Por el contrario, la tasa de mortalidad estandarizada por edad ha disminuido casi un 59% en ese mismo período4. Este aumento de la prevalencia afecta sobre todo a personas de mediana edad y a mujeres, y puede explicarse por un aumento del asma alérgica, condicionada por el efecto de los factores de tipo ambiental y climático5. Otros estudios recientes constatan prevalencias muy dispares en función de diferentes variables como la edad (adolescentes), con una prevalencia entre el 10,6%6 y el 13,4%7; el método diagnóstico empleado (autorreferido por el paciente) con un 13,5%8, o el ámbito del estudio (ambiente laboral) con un 2,5%9.
Factores de riesgoEs importante distinguir entre los factores que se asocian a la aparición del síndrome asmático y aquellos que producen agudización o síntomas de asma. De entre los factores asociados a la aparición de asma cabe destacar, por ser los más estudiados o con mayor asociación, factores del huésped como atopia, menarquia temprana, obesidad, rinitis o hiperrespuesta bronquial, y factores perinatales como la edad materna, la prematuridad, la preeclampsia, la lactancia, el consumo de tabaco durante la gestación, la dieta de la madre, la dieta del lactante o la función pulmonar del neonato.
Por otro lado, encontramos los factores desencadenantes de síntomas o agudizaciones. Es importante conocerlos, ya que producen situaciones graves y deben ser evitados. Aquí se incluyen factores ambientales como: polución, pólenes, ácaros del polvo, hongos y virus; fármacos como el ácido acetilsalicílico (AAS) y algunos antibióticos, alimentos, veneno de himenópteros o sustancias empleadas en la industria (plásticos, barnices, esmaltes, imprentas, látex, etc.)1.
Además, los factores genéticos están adquiriendo cada vez mayor relevancia a medida que avanza la investigación. Los estudios actuales destacan su protagonismo en la aparición de asma, la expresión fenotípica de la enfermedad, la respuesta individual a los factores desencadenantes de síntomas o de agudizaciones y, muy especialmente, en la respuesta a las nuevas terapias en los casos de asma grave10.
Finalmente, existe una evidencia creciente sobre la importancia de la contaminación ambiental, tanto en el interior de los edificios por la combustión de biomasa, como en el aire exterior por la combustión de los productos de origen fósil. Esta contaminación ambiental se comporta como un factor asociado a la aparición de asma y como factor desencadenante de síntomas o de agudizaciones. Además, contribuye a incrementar la morbimortalidad del asma, así como la incidencia de otras enfermedades respiratorias crónicas, enfermedades cardiovasculares y diversos tipos de cáncer11,12.
PatogeniaLa presencia de inflamación de la vía respiratoria que afecta a toda la vía respiratoria, incluida la mucosa nasal, es una característica común del asma, presente aun cuando los síntomas son intermitentes. Sin embargo, la relación entre la gravedad del asma y la intensidad de la inflamación no se ha establecido de forma consistente13. La célula clave en la patogenia del asma es el eosinófilo. En la mayoría de los pacientes asmáticos, el patrón inflamatorio característico se produce a expensas de un aumento en el número de eosinófilos activados, mastocitos, células natural killer y linfocitos T helper tipo 2 (Th2) que liberan citocinas proinflamatorias tipo 2 como la interleucina 4 (IL-4), IL-5 y la IL-13 que ocasionan los síntomas típicos de la enfermedad. Las propias células estructurales de la vía aérea también participan en la producción de mediadores que contribuyen y perpetúan este estado inflamatorio local14. Estudios recientes muestran que no todos los pacientes desarrollan la inflamación Th2, sino que también hay otras moléculas como la IL-17 y el IF-g que intervendrían en la denominada asma Th2 bajo1.
Junto a la inflamación, la vía aérea de los asmáticos experimenta unos cambios estructurales que se conocen como remodelado y que se relacionan con la gravedad de la obstrucción y que, en algunos casos, se vuelve irreversible15. Entre estos cambios, encontramos un engrosamiento de la capa reticular de la membrana basal, fibrosis subepitelial, hipertrofia e hiperplasia de células musculares lisas, proliferación y dilatación de vasos, hiperplasia de glándulas e hipersecreción mucosa que se asocia con una pérdida progresiva de la función pulmonar y pueden conducir a la obstrucción bronquial de forma irreversible15.
El estrechamiento de la vía aérea es el final común al que conducen los cambios fisiopatológicos comentados, y el origen de la mayoría de los síntomas. Esta limitación al flujo aéreo y los síntomas que desencadena pueden resolverse de forma espontánea o en respuesta a la medicación (reversibilidad) e incluso permanecer ausentes durante algún tiempo en un paciente determinado. Entre los mecanismos que conducen a esta obstrucción encontramos la contracción del músculo liso, el edema de la vía respiratoria (por exudado en respuesta a mediadores inflamatorios), la hipersecreción de moco y los cambios estructurales que hemos comentado previamente.
ClasificaciónEl asma se ha clasificado habitualmente en función de la gravedad, aunque la definición y evaluación de esta característica ha ido evolucionando con el tiempo1,16,17.
La gravedad del asma es una propiedad intrínseca de la enfermedad que refleja la intensidad de las anomalías fisiopatológicas18. Tradicionalmente el asma se ha clasificado según parámetros clínicos y funcionales en 4 categorías: intermitente, persistente leve, persistente moderada y persistente grave (tabla 1). La gravedad del asma implica tanto a la intensidad del proceso como a la respuesta al tratamiento. Esta gravedad se evalúa en función de las necesidades de tratamiento de mantenimiento requeridas para alcanzar el control de síntomas y exacerbaciones19,20.
Clasificación de la gravedad del asma cuando está bien controlada con tratamiento
| Gravedad | Intermitente | Persistente | ||
|---|---|---|---|---|
| Leve | Moderada | Grave | ||
| Necesidades mínimas de tratamiento para mantener el control | Escalón 1 | Escalón 2 | Escalón 3 o 4 | Escalón 5 o 6 |
Adaptada de Guía española1.
Esta clasificación no es algo estático, sino que puede variar a lo largo del tiempo, por lo que es necesario reevaluar a los pacientes de manera periódica. La mayoría de la población asmática padece asma intermitente o persistente leve21,22; sin embargo, a pesar de ser formas aparentemente no graves, no se debe subestimar su carácter inflamatorio23,24. La ausencia de síntomas con la que cursan el asma leve y la intermitente precisan de una correcta valoración clínica y funcional del paciente para su correcta clasificación y ajuste en consecuencia del tratamiento. Además, el asma se puede clasificar estableciendo una relación entre la gravedad y el control de los síntomas de la enfermedad, de manera que podemos clasificarla en asma bien controlada, asma parcialmente controlada y asma mal controlada como podemos apreciar en la tabla 21.
Clasificación del control del asma en pacientes adultos
| Bien controlada | Parcialmente controlada | Mal controlada | |
|---|---|---|---|
| Síntomas diurnos | Ninguno o ≤2 días al mes | >2 días al mes | |
| Limitación de actividades | Ninguna | Cualquiera | |
| Síntomas nocturnos/despertares | Ninguno | Cualquiera | |
| Necesidad de medicación de rescate (agonistas beta-2 adrenérgico de acción corta) | Ninguna o ≤2 días al mes | >2 días al mes | Si ≥ 3 características de asma parcialmente controlada |
| Función pulmonarFEV1PEF | ≥80% del valor teórico o Z-score (−1,64)≥80% del mejor valor personal | <80% del valor teórico o Z-score (−1,64)<80% del mejor valor personal | |
| Exacerbaciones | Ninguna | ≥1 al año | ≥1 en cualquier semana |
FEV1: volumen espiratorio forzado en el primer segundo; PEF: flujo espiratorio máximo. Adaptada de Guía española1.
Por lo tanto, al tratar de minimizar la expresión clínica del asma, deben tenerse en cuenta dos dominios fundamentales: por una parte, las manifestaciones de la enfermedad presentes en el día a día del paciente (control actual) y, por otra, sus posibles consecuencias (riesgo futuro) que se exponen más adelante.
Manifestaciones clínicasEl diagnóstico de sospecha del asma es fundamentalmente clínico y debemos sospecharla ante una tos persistente, sibilancias, dificultad respiratoria y opresión torácica. Estos son los llamados síntomas guía y son variables en tiempo e intensidad y de predominio nocturno y pueden ser provocados por distintos desencadenantes (infecciones víricas, alérgenos, humo, ejercicio, emociones, etc.). Las variaciones estacionales, así como los antecedentes familiares o personales de atopia y rinitis son aspectos importantes a tener en cuenta en la historia clínica.
Habitualmente aparecen varios signos a la vez, cuando se muestran de forma aislada suelen ser poco indicativos de asma. Ninguno de estos signos es específico del asma y por ello necesitamos emplear pruebas objetivas para su diagnóstico; habitualmente se trata de pruebas respiratorias funcionales.
En la exploración física, lo más característico son las sibilancias durante la auscultación, aunque una exploración normal no descarta el diagnóstico de asma. También son características la rinosinusitis, la dermatitis y la historia familiar de asma o atopia1.
DiagnósticoEspirometría con prueba broncodilatadoraEl diagnóstico se establece cuando, en un paciente con sospecha de asma, una espirometría forzada demuestra una alteración obstructiva variable del flujo espiratorio, con un cociente FEV1/FVC (volumen espiratorio máximo en el primer segundo/capacidad vital forzada) por debajo del 70%25. Un FEV1 reducido con una relación FEV1/FVC menor de 0,7 confirma la obstrucción, ayuda a establecer su gravedad e indica un mayor riesgo de exacerbaciones26.
Por otro lado, muchos enfermos con asma pueden presentar una espirometría con valores en el margen de referencia, o incluso con un patrón no obstructivo (restrictivo) por atrapamiento aéreo. Para el diagnóstico del asma es básico utilizar la prueba de broncodilatación, consistente en administrar 4 inhalaciones de 100μg de salbutamol, mediante un inhalador presurizado, y repetir la espirometría a los 15 minutos. Se considera que la respuesta es positiva si hay un aumento de la FEV1 igual o superior al 12% y 200ml o más respecto al valor basal. Aunque característica del asma, la reversibilidad de la obstrucción bronquial no está presente en todos los pacientes. Un criterio de broncodilatación alternativo es un aumento del flujo espiratorio máximo (PEF) superior al 20% en más de tres días en una misma semana27. La reversibilidad también puede ser identificada por una mejoría del FEV1 o del PEF tras 2 semanas de tratamiento con glucocorticoides sistémicos o inhalados1.
Prueba de hiperreactividad bronquial inespecíficaEn los casos dudosos, la prueba de provocación bronquial inespecífica realizada con sustancias broncoconstrictoras (metacolina, histamina, manitol), hiperventilación o ejercicio se considera positiva si se produce una caída en el FEV1 superior al 20%1.
Fracción exhalada de óxido nítricoLa fracción exhalada de óxido nítrico (FENO) mide de forma no invasiva la inflamación eosinofílica de las vías aéreas. El procedimiento de determinación ha sido estandarizado, y el punto de corte en adultos para el diagnóstico se ha establecido en 40 ppb. Tiene una elevada sensibilidad y especificidad para el diagnóstico de asma. Factores como el tabaco, la obstrucción y el tratamiento previo con esteroides inhalados pueden afectar a su determinación1.
Estudio de alergiaEl objetivo del estudio de alergia en pacientes con sospecha de asma es el de identificar aquellas sustancias (aeroalérgenos) que son potencialmente evitables y que influyen en el desarrollo del asma o de sus exacerbaciones. La prueba de punción epidérmica o prick-test es el método de elección por su alta sensibilidad, bajo coste y posibilidad de valoración inmediata. La alternativa a esta prueba es la determinación de IgE específica, más costosa, menos sensible y sin posibilidad de obtención de resultados instantánea. En ambos casos, sería necesario correlacionar los resultados con la historia clínica para establecer el diagnóstico1.
TratamientoEl objetivo principal del tratamiento es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones, la obstrucción al flujo aéreo y los efectos secundarios derivados del tratamiento y reducir al máximo la mortalidad1,16.
Los objetivos del tratamiento (tabla 3), tanto en su vertiente de controlar los síntomas diarios (dominio de control actual), como en la de prevenir las exacerbaciones y la pérdida exagerada de función pulmonar (dominio de riesgo futuro), pueden alcanzarse en una gran mayoría de los pacientes con un tratamiento adecuado.
Objetivos del tratamiento del asma
| En el dominio de control actual |
| Prevenir los síntomas diurnos, nocturnos y tras el ejercicio físico |
| Uso de agonista beta-2 adrenérgico de acción corta no más de 2 veces al mes |
| Mantener una función pulmonar normal o casi normal |
| Sin restricciones en la vida cotidiana ni para realizar ejercicio físico |
| Cumplir las expectativas de los pacientes y sus familias |
| En el dominio de riesgo futuro |
| Prevenir las exacerbaciones y la mortalidad |
| Minimizar la pérdida progresiva de la función pulmonar |
| Evitar los efectos adversos del tratamiento |
| Evitar la inercia terapéutica |
Adaptada de Guía española1.
Para conseguirlo, se seguirá una estrategia global e individualizada a largo plazo, basada en un tratamiento farmacológico óptimo ajustado, junto a medidas de supervisión, control ambiental y educación para el asma28. El tratamiento farmacológico debe ajustarse según el nivel de control del paciente, considerando las opciones terapéuticas más efectivas, la seguridad y el coste de las distintas alternativas, y teniendo en cuenta la satisfacción del paciente1.
El tratamiento del asma debe seguir un plan global, consensuado entre el médico y el paciente (y su familia), en el que deben quedar claros los objetivos, los medios para lograrlos y las pautas para su modificación o adaptación a las circunstancias cambiantes de la enfermedad. La diferenciación de los dominios de control actual y riesgo futuro en el control es importante, porque se ha documentado que estos pueden responder de forma distinta al tratamiento29,30.
Por ejemplo, algunos pacientes pueden tener un buen control diario de los síntomas de asma y, sin embargo, sufrir exacerbaciones y viceversa.
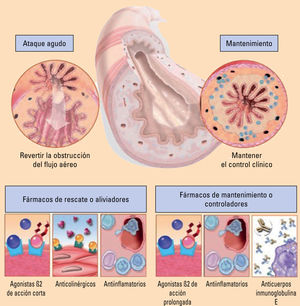
Tratamiento farmacológicoLos fármacos que se utilizan para el asma se clasifican en 2 tipos (fig. 1).
Principios de la farmacología en el asma. Adaptada de SEPAR41.
Es aquel tratamiento que se pauta de forma continua durante períodos prolongados. Estos fármacos reducen la inflamación de las vías aéreas, controlan los síntomas y reducen las exacerbaciones y la pérdida de la función pulmonar. Son los glucocorticoides inhalados o sistémicos, los antagonistas de los receptores de los leucotrienos (ARLT), los agonistas beta-2 adrenérgicos de larga duración (LABA), anticolinérgicos de larga duración (LAMA) (tiotropio) y anticuerpos monoclonales (omalizumab, mepolizumab, reslizumab, benralizumab y dupilumab). Las cromonas y la teofilina de liberación retardada han caído en desuso debido a su menor eficacia.
Medicamentos de alivio o rescateEs aquel tratamiento que se utiliza a demanda para tratar o prevenir la broncoconstricción y aliviar los síntomas de forma rápida. Estos fármacos son los agonistas beta-2 adrenérgicos de corta duración (SABA) (salbutamol) y los anticolinérgicos de corta duración inhalados (SAMA) (bromuro de ipratropio).
También está aceptada e incluida ya en las guías de práctica clínica1,16 la posibilidad de emplear un glucocorticoide inhalado (GCI) en dosis bajas/LABA de acción rápida (formoterol), en un mismo dispositivo, como mediación de rescate.
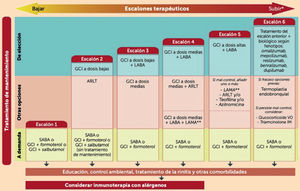
En total, hay cuatro categorías de asma: intermitente, persistente leve, persistente moderada y persistente grave. Enumeraremos a continuación el tratamiento farmacológico adecuado en cada nivel de gravedad. Existen seis escalones terapéuticos según la GEMA10 para alcanzar el control del asma (fig. 2).
Escalones de tratamiento del asma. ARLT: antagonista de los receptores de los leucotrienos; GCI: glucocorticoide inhalado; IM: intramuscular; LABA: agonista beta-2 adrenérgico de acción prolongada; LAMA: anticolinérgicos de acción larga; SABA: agonista beta-2 adrenérgico de acción corta. *Tras confirmar la correcta adhesión terapéutica y el empleo del inhalador/es. **LAMA: tiotropio o glicopirronio; VO: vía oral. Adaptada de Guía española1.
En este escalón se ubican los pacientes con síntomas diurnos leves que se presentan de forma ocasional, que mantienen una buena función pulmonar y no han presentado exacerbaciones en el año previo ni tienen riesgo de padecerlas. El tratamiento de elección en este escalón son SABA inhalados (salbutamol o terbutalina), exclusivamente a demanda. En casos de intolerancia se puede administrar SAMA (bromuro de ipratropio). Las últimas guías de práctica clínica, tanto nacionales como internacionales, señalan que se puede emplear en este escalón también la asociación GCI/formoterol o GCI/salbutamol o salbutamol/dipropionato de beclometasona (DPBM) a demanda terapéutico; sin embargo, esta indicación no está considerada en la ficha técnica de estos medicamentos. Los SABA son el tratamiento de elección para prevenir una broncoconstricción inducida por ejercicio, aplicándose 25 minutos antes de la actividad física. Si durante el transcurso de la enfermedad, el paciente presentara un empeoramiento sintomático progresivo con presencia de exacerbaciones en el año previo, pérdida de la función pulmonar con un FEV1 inferior al 80% o necesidad de aumentar la dosis de SABA a más de 2 veces a la semana, tendríamos que pautar un tratamiento de mantenimiento que sería el siguiente escalón terapéutico1,31.
Escalón 2: asma persistente levePacientes que aún no están recibiendo tratamiento y no presentan sintomatología diaria, tienen síntomas nocturnos menos de 1 vez a la semana, precisan poca medicación de rescate, no tienen prácticamente limitación para la realización de actividades, presentan una función pulmonar dentro de la normalidad (FEV1 mayor del 80%) y tienen una o ninguna exacerbación al año31.
El tratamiento de elección son los GCI (beclometasona, budesonida, ciclesonida, fluticasona o mometasona) en dosis bajas de forma continua, junto con los SABA como medicación de rescate. Estudios realizados podrían proporcionar evidencia para la indicación de las combinaciones de GCI en dosis bajas con LABA o SABA (por ejemplo: budesonida/formoterol, beclometasona/formoterol o beclometasona/salbutamol) administrados a demanda en el tratamiento del escalón 2, en pacientes con baja adhesión terapéutica en los que fracasó una intervención educativa específica. En este nivel existe otra alternativa terapéutica que es el uso de ARLT (montelukast) por vía oral de forma continua. Sin embargo, diversos estudios concluyen que los GCI de mantenimiento en dosis bajas continúan siendo superiores a largo plazo32.
Escalón 3: asma persistente moderadaEn este nivel, el tratamiento de elección es la combinación de un GCI en dosis bajas con un LABA (salmeterol, formoterol o vilanterol) inhalados33,34, que pueden administrarse preferentemente en un mismo dispositivo35 o por separado. Con esta combinación disminuyen los síntomas, mejora la función pulmonar, se reducen las exacerbaciones y el uso de medicación de alivio de forma más pronunciada que aumentando la dosis de GCI. Los LABA no deben emplearse en monoterapia, por lo que siempre deben ir acompañados de un GCI, ya que se han asociado con un mayor riesgo de hospitalizaciones y exacerbaciones de riesgo vital36,37. Por ejemplo, fluticasona propionato con salmeterol o budesonida con formoterol (de las más empleadas en España).
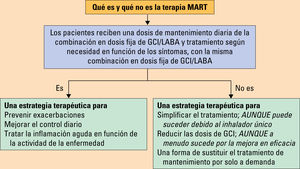
El formoterol es un LABA pero de inicio rápido. Por este motivo, si se elige la combinación de budesonida/formoterol o beclometasona/formoterol puede utilizarse tanto como tratamiento de mantenimiento como de alivio (MART). Siempre que se emplee la estrategia MART se hará con un único dispositivo de inhalación (fig. 3).
¿Qué es y qué no es la terapia MART? GCI: glucocorticoides inhalados; LABA: agonista beta-2 adrenérgico de acción larga. Tomada de SEPAR41.
Alternativamente, puede utilizarse un GCI en dosis bajas asociado a un ARLT que ha mostrado ser superior a la monoterapia con GCI y, aunque no es tan eficaz como la combinación de GCI y LABA, ofrece una excelente seguridad. Sin embargo, no parece que la adición de un ARLT permita reducir la dosis de GCI1.
Escalón 4: asma persistente moderadaEl tratamiento de elección en este nivel es la combinación de un GCI en dosis medias con un LABA. Como alternativa, puede utilizarse la combinación de un GCI en dosis medias con un ARLT, aunque la adición del LABA al GCI es superior en la prevención de exacerbaciones, en el control diario de síntomas y en la mejoría de la función pulmonar.
En pacientes con asma no controlada a pesar del tratamiento anterior puede considerarse la triple terapia que incluye GCI en dosis medias, LABA y LAMA (tiotropio o glicopirronio).
Escalón 5: asma persistente graveTratamiento con altas dosis de GCI en combinación con LABA38,39. En pacientes que no estén bien controlados con la combinación de un GCI en dosis altas y un LABA y que tengan una obstrucción bronquial, se pueden añadir otros fármacos de mantenimiento como ARLT o teofilinas de liberación retardada o anticolinérgicos40,41.
La azitromicina administrada tres días a la semana durante meses puede emplearse como tratamiento añadido en pacientes con asma grave42,43.
Escalón 6: asma persistente graveSi a pesar del tratamiento persiste un mal control de la enfermedad, se debe considerar la administración de fármacos biológicos. En los casos de asma grave no controlada (AGNC) alérgica se puede añadir el anticuerpo monoclonal anti-IgE (omalizumab). En pacientes con AGNC eosinofílica, se pueden utilizar fármacos biológicos anti-interleucina-5 (IL-5) mepolizumab, reslizumab y benralizumab o dupilumab que es un anticuerpo monoclonal humano dirigido contra la cadena alfa del receptor de la IL-444,45.
En caso de que la administración de fármacos biológicos fracase, se puede considerar la indicación de termoplastia endobronquial46. Como último recurso terapéutico tenemos la administración de corticoides por vía sistémica, siempre en la dosis más baja y eficaz y durante el menor tiempo posible.
Otros tratamientosTabaquismo y control ambientalEl primer objetivo del control ambiental es conseguir que el paciente abandone el tabaquismo. Para ello, se le debe informar sobre los métodos adecuados para conseguir la deshabituación. La exposición a contaminantes ambientales y la exposición pasiva al humo de tabaco, por un lado, empeoran el curso del asma y, por otro, constituyen un factor de riesgo para desarrollar asma en la infancia47..También se ha visto que la exposición al humo de cigarrillos electrónicos se relaciona con exacerbaciones asmáticas.
Algunos pacientes pueden presentar exacerbaciones con toma de AAS y antiinflamatorios no esteroideos (AINE), por lo que es necesario que los pacientes estén correctamente diagnosticados, ya que estas exacerbaciones son graves e incluso mortales. En el asma alérgica se debe evitar la exposición al alérgeno que produce la exacerbación asmática.
La vacunación antigripal y frente al neumococo ha mostrado utilidad al reducir el número y gravedad de las exacerbaciones1.
Inmunoterapia con alérgenosLa inmunoterapia por vía subcutánea con extractos alergénicos es un tratamiento eficaz para el asma alérgica bien controlada con niveles bajos o medios de tratamiento (escalones terapéuticos 2 a 4), siempre que se haya demostrado una sensibilización mediada por IgE frente a aeroalérgenos comunes que sea clínicamente relevante.
La inmunoterapia sublingual en liofilizado oral de ácaros, cuando se añade al tratamiento farmacológico reglado de mantenimiento, es capaz de disminuir el número de exacerbaciones de moderadas a graves y mejorar el control de la enfermedad, con muy buen perfil de seguridad. Por ello, es recomendable su uso en pacientes adultos con asma moderada controlada o parcialmente controlada1.
La ventaja adicional de la inmunoterapia frente a la farmacoterapia es mantener los beneficios clínicos obtenidos hasta varios años después de la retirada del tratamiento.
Educación en asmaLa educación del paciente asmático haciéndole conocedor de las características de su patología es de vital importancia para el buen control de la enfermedad, ya que se asocia a una correcta adherencia terapéutica. De forma que podríamos decir que las medidas no farmacológicas también tienen un gran peso en el control del asma (tabla 4)1.
Habilidades básicas del paciente asmático
| Conocer que el asma es una enfermedad crónica y necesita tratamiento continuo aunque no tenga molestias |
| Saber las diferencias que existen entre inflamaciones y broncoconstricción |
| Diferenciar los fármacos «controladores» de la inflamación de los «aliviadores» de la obstrucción |
| Usar correctamente los inhaladores. Realizar después de la inhalación las medidas recomendadas para disminuir los efectos adversos locales |
| Identificar y evitar en lo posible los desencadenantes. Combatir el tabaquismo activo y pasivo |
| Monitorizar los síntomas y, en algunos casos, también el flujo espiratorio máximo (PEF) |
| Reconocer los signos y síntomas de agravamiento de la enfermedad (pérdida del control) |
| Actuar ante un deterioro de su enfermedad para prevenir la crisis de asma |
Adaptada de Guía española1.
Para el control de esta enfermedad, es muy importante la reevaluación del paciente, que se realizará mediante una visita médica en la que se evalúan los dominios de control actual y futuro de riesgo, la obstrucción del flujo aéreo (mediante espirometría forzada, siendo un valor de FEV1 menor del 60% un factor de riesgo para exacerbaciones), los efectos adversos de los tratamientos y la adhesión terapéutica. Con el fin de facilitar esta evaluación, se han desarrollado cuestionarios fáciles de cumplimentar por el paciente. De ellos, han sido validados y adaptados culturalmente el test de control del asma (ACT)48,49 y el cuestionario de control del asma (ACQ)50,51.
El ACT (fig. 4) está más orientado a su uso en la clínica diaria, con puntos de corte definidos, de forma que una puntuación igual o superior a 20 es muy consistente con un asma bien controlada, una puntuación entre 19 y 16 con un asma parcialmente o no bien controlada y una puntuación igual o inferior a 15 con un asma mal controlada48,49.
En la ACQ, la puntuación para el asma bien controlada es inferior a 0,5; para el asma parcialmente controlada entre 0,5 y 0,99 y para el asma mal controlada superior a 1. Sin embargo, estos cuestionarios no deben ser empleados como única herramienta para la detección del asma mal controlada52.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
-
 Importante
Importante
-
 Muy importante
Muy importante
-
 Metaanálisis
Metaanálisis
-
 Ensayo clínico controlado
Ensayo clínico controlado
-
 Epidemiología
Epidemiología
-
 Artículo de revisión
Artículo de revisión
-
 Guía de práctica clínica
Guía de práctica clínica