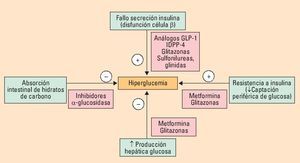
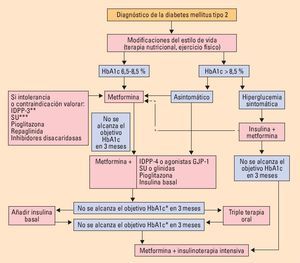
La diabetes tipo 2 es una enfermedad compleja y progresiva, en rápido crecimiento debido al aumento de la obesidad, principalmente. Los defectos fisiopatológicos básicos radican en la insulin resistencia de los tejidos periféricos y la progresiva disfunción de la célula β pancreática que ocasiona una inadecuada secreción de insulina. Existe una variedad de fármacos orales o parenterales para su tratamiento (metformina, glitazonas, sulfonilureas, glinidas, análogos del GLP-1, inhibidores del DPP-4, inhibidores de la α-glucosidasa intestinal, insulina) que se dirigen a defectos fisiopatológicos específicos cada uno con sus ventajas e inconvenientes, de tal forma que el tratamiento combinado proporcionará ventajas para el control glucémico. Pero el tratamiento deberá ser siempre personalizado planteándose unos objetivos glucémicos realistas y seguros, adaptados a la edad, presencia de otras comorbilidades o enfermedad macrovascular establecida y años de duración de la diabetes.
Identifíquese
¿Aún no es suscriptor de la revista?
Comprar el acceso al artículo
Comprando el artículo el pdf del mismo podrá ser descargado
Teléfono para incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h
Llamadas desde España
932 415 960
Llamadas desde fuera de España
+34 932 415 960