Nuestro organismo se ve expuesto a microorganismos patogénicos que intentan colonizarnos, causan enfermedades e incluso comprometen nuestra supervivencia. El sistema inmune es la herramienta fisiológica formada por un conjunto de moléculas, células y tejidos que nos defienden de las agresiones causadas por los patógenos o los tumores. En esta actualización se aborda la relevancia del sistema inmune para asegurar nuestra supervivencia.
El sistema inmune innatoRepresenta la primera línea de defensa y es el encargado de realizar respuestas rápidas y eficientes frente a los patógenos. Proporciona al sistema adaptativo el tiempo necesario para activarse, expandirse y seleccionar la mejor defensa para terminar con ellos.
Componentes celulares del sistema inmune innatoPara realizar su función defensiva, el sistema inmune innato se ayuda de un conjunto de células especializadas: los granulocitos, incluyen a los neutrófilos, principales defensores frente a patógenos fagocitables, bacterias y hongos, y a los eosinófilos y basófilos, que nos protegen de parásitos no fagocitables y helmintos. Los monocitos, macrófagos y células dendríticas destruyen microorganismos y los procesan presentándoselos al sistema adaptativo. Las células natural killer son las encargadas de eliminar células infectadas por virus o tumorales.
Palabras clave
Our body is exposed to pathogenic microorganisms that try to colonize us, cause illness and even compromise our survival. Immune system is the physiological tool consists of a set of molecules, cells and tissues that defend us from attacks caused by pathogens or tumors. In this chapter the relevance of the immune system to ensure our survival is addressed.
The innate immune systemIt represents the first line of defense and it is responsible for quick and efficient responses to pathogens. It provides the time needed to activate the adaptive system and expand and select the best defense to finish them.
Cellular components of the innate immune systemTo perform its defensive function, innate immune system is aided by a set of specialized cells: granulocytes, including neutrophils, leading advocates against fagocitables pathogens, bacteria and fungi, and eosinophils and basophils, which protect us from parasites not phagocitables and helminths. Monocytes, macrophages and dendritic cells destroy microorganisms, processing and presenting them to the adaptive system. Natural killer cells are responsible for eliminating virus-infected cells or tumors.
Keywords
Todos los días, nuestro organismo está expuesto a microorganismos que son inhalados, ingeridos o que, incluso, coexisten con nosotros en nuestra piel o mucosas. Estos microorganismos, esencialmente aquellos especializados en la infección y definidos como patogénicos, probablemente habrían sido capaces de extinguir a nuestra especie1. Sin embargo, en la coevolución del ser humano con los patógenos, y en general en los vertebrados, la naturaleza ha sido capaz de desarrollar dos tipos celulares exclusivos que realizan un proceso genético único y que han sido los principales responsables de asegurar nuestra supervivencia a lo largo de los tiempos. Estos dos tipos celulares son los linfocitos T y B, y el proceso genético se denomina «recombinación somática». Este mecanismo genético exclusivo, consiste en la recombinación azarística de unos pocos genes para generar un «enorme», amplio y diverso número de células T y B defensivas distintas, cada una con una capacidad de reconocimiento única.
No obstante, el papel defensivo de nuestro organismo no es exclusivo de estos dos tipos celulares, sino que participan otros importantes tipos celulares y moleculares que conforman nuestro «sistema inmune». De esta manera, podemos definir al sistema inmune como el conjunto de células y moléculas capaces de diferenciar lo «propio» de lo «extraño», lo «ofensivo» de lo «inofensivo». Es un sistema que se caracteriza por su capacidad de reconocimiento molecular y por mantener la identidad bioquímica de nuestro organismo. Además, es un sistema de autodefensa que no solo se limita al reconocimiento de microorganismos patogénicos, sino que diariamente reconoce oncoproteínas y elimina células neoplásicas. Así, el sistema inmune proporciona los mecanismos críticos para el rápido reconocimiento y eliminación de los patógenos2. La respuesta inmune se definiría como la respuesta global y coordinada de todas estas células y moléculas ante los patógenos y células neoplásicas.
El conjunto de antígenos propios lo formarían todas aquellas moléculas reconocidas por el sistema inmune que forman parte de nuestra estructura molecular a nivel individual. Estas células defensivas deberán ser previamente generadas y «educadas» para reconocer nuestras estructuras propias en lugares asépticos denominados órganos linfoides primarios: la médula ósea y el timo. Este proceso de aprendizaje se denomina tolerancia central. Por otro lado, los antígenos extraños serían aquellas moléculas reconocidas por el sistema inmune que no forman parte de nuestro organismo y potencialmente son patogénicos. Ahora bien, todo lo extraño no es ofensivo, ni todo lo propio debe ser tolerado, como puede ser el caso de una partícula de polen, inofensiva y que no debería activar a las células defensivas o, por ejemplo, una célula propia neoplásica, que podría pasar desapercibida ante nuestro sistema defensivo. En principio, el sistema inmune está capacitado para realizar estas distinciones y ejercer su función protectora adecuadamente.
El conocimiento de la naturaleza de los antígenos también es esencial para entender al sistema inmune. De partida, es un sistema que reconoce principalmente proteínas, y en concreto pequeñas secuencias de aminoácidos; sin embargo, también es capaz de reconocer antígenos de distinta naturaleza molecular como son los lípidos, lipopolisacáridos, lipoarabinomananos, glúcidos, ácidos micólicos y ceramidas, entre otros.
Por último, todos estos conceptos sobre el sistema inmune no tendrían sentido sin entender que la clave para reconocer y discriminar los patógenos reside en la expresión por parte de nuestras células defensivas de diferentes clases de receptores de membrana con diferentes especializaciones. Señalemos, por ejemplo, la familia de los receptores de tipo toll (TLR o toll like receptors) capaces de reconocer grupos de patógenos con características moleculares comunes, o los receptores de las células T y B (TCR y BCR, respectivamente) capaces ambos de reconocer y diferenciar específicamente unos microorganismos de otros.
Si bien el sistema inmune es el responsable de nuestra supervivencia como especie, no es infalible, y presenta defectos a nivel individual, siendo más de un tercio de las muertes del planeta debidas a fallos de nuestro sistema defensivo. Cuando el sistema inmune no realiza correctamente los procesos de tolerancia central comienza la autorreactividad, que puede progresar a una enfermedad autoinmune. Si el sistema responde a antígenos extraños, pero inofensivos, pueden comenzar las patologías alérgicas, y si el sistema no reconoce células propias transformadas aparecen las neoplasias.
Componentes del sistema inmune: origen y características principalesLas células y moléculas del sistema inmune se estratifican en dos grandes grupos en función de su tiempo de respuesta, su especificidad de reconocimiento, la presencia de recombinación genética, los tipos de receptores que expresan o incluso la presencia o no de memoria, entre otras propiedades. Estos dos grupos son las respuestas innatas y las adaptativas.
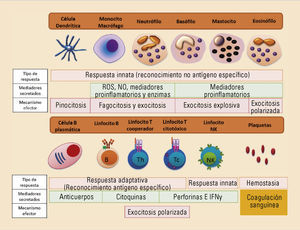
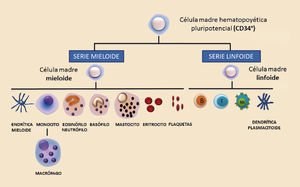
Las respuestas inmunes innatas incluyen las barreras físicas, las barreras químicas y los componentes celulares y moleculares propios del sistema inmune. Dentro de los componentes celulares se encuentran los granulocitos (neutrófilos, eosinófilos, basófilos y mastocitos), los monocitos y macrófagos, las células dendríticas y de Langerhans y las células citotóxicas naturales (generalmente llamadas natural killer —NK—). Los componentes moleculares están representados principalmente por el complemento, las citocinas y las proteínas de fase aguda. Filogenéticamente, son células y moléculas que se pueden hallar hasta en los animales más sencillos. Las respuestas inmunes adaptativas están exclusivamente compuestas por reacciones antígeno-específicas mediadas por los linfocitos T y los linfocitos B, y son exclusivas de los animales superiores. La estirpe mieloide da lugar a toda la serie mieloide compuesta por los granulocitos, mastocitos, células dendríticas mieloides, monocitos y macrófagos. Por otro lado, la estirpe linfoide da lugar a los tres tipos de linfocitos: T, B y NK, y a las células dendríticas plasmacitoides (fig. 1).
Componentes celulares del sistema inmune innato y adaptativo. Principales características en función del tipo de respuesta realizada, su mecanismo efector y los mediadores secretados. IFN: interferón; NK: natural killer. ; NO: óxido nítrico; ROS: especies reactivas derivadas del oxígeno.
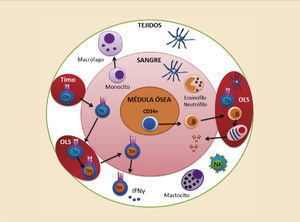
Los distintos componentes celulares del sistema inmune se distribuyen en capas, aumentando así la eficiencia defensiva ante los microorganismos infecciosos. En primer lugar se encuentran los mastocitos, macrófagos y células dendríticas en forma de células centinela vigilando posibles entradas de los patógenos a través de la dermis o las mucosas. Los neutrófilos, eosinófilos y basófilos se encuentran circulando en el torrente sanguíneo, vigilando y esperando una señal inflamatoria oportuna para extravasarse. Los linfocitos T y algunas células B recirculan por toda la sangre, órganos linfoides secundarios y tejidos buscando sus antígenos específicos para realizar su función defensiva (fig. 2).
Todos estos componentes celulares del sistema inmune proceden de los órganos linfoides primarios. Durante las primeras fases del desarrollo derivan parte del hígado fetal y posteriormente de la médula ósea y el timo. Las células del sistema inmune se diferencian a partir de un único precursor hematopoyético caracterizado por expresar el marcador CD34, situado principalmente en la médula ósea, si bien también podemos encontrar esta célula pluripotencial en la sangre periférica y en el cordón umbilical3. A partir de este precursor se generan dos grandes estirpes de diferenciación: la estirpe mieloide y la estirpe linfoide (fig. 3).
Tipos celulares del sistema inmune innatoA continuación se definirán y caracterizarán las principales poblaciones celulares que componen el sistema inmune innato, dónde se originan y cómo se clasifican. Se estudiarán los neutrófilos, eosinófilos y basófilos; los mastocitos, monocitos, macrófagos, las células dendríticas y los linfocitos NK. Sus propiedades serán ampliadas posteriormente en la actualización de esta unidad temática dedicada a las respuestas innatas y cómo realizan su función defensiva.
GranulocitosLos granulocitos, también denominados polimorfonucleados (PMN) debido a las formas multilobuladas que pueden presentar en su núcleo, se caracterizan por la presencia de abundantes gránulos localizados en su citoplasma, y mediante su avidez a distintas tinciones han dado lugar a sus denominaciones: neutrófilos, eosinófilos y basófilos.
NeutrófilosLos neutrófilos son el tipo celular defensivo más abundante en nuestra sangre, en torno al 60-70% de los leucocitos en adultos, y representan la principal herramienta fagocítica que utiliza el sistema inmune en la eliminación de patógenos fagocitables. Son células que se reclutan muy rápidamente al foco de la infección, poseyendo un papel crítico defensivo frente a bacterias extracelulares y hongos4. Además, son capaces de liberar grandes cantidades de citocinas y quimiocinas, siendo piezas clave de los procesos de inflamación.
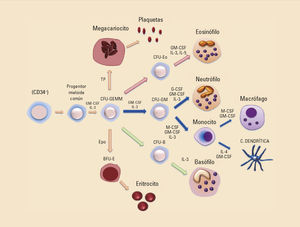
Morfológicamente, los neutrófilos tienen el núcleo multilobulado y un tamaño de 10-12 a 20 micras. Se originan en la línea mieloide, derivan de un precursor común que genera el progenitor de los granulocitos, monocitos y megacariocitos (precursor del linaje mielocítico, CFU-GEMM, CFU —unidad formadora de colonias—). Como consecuencia se formará un nuevo precursor, el CFU-GM (precursor CFU-granulocitos-macrófagos) que derivará en los neutrófilos o en los monocitos (fig. 4). Las interleucinas: factor estimulante de colonias de granulocitos (G-CSF), de granulocitos-monocitos (GM-CSF) e interleucina (IL)-3 serán las encargadas de dirigir la diferenciación hacia el neutrófilo. En este momento de la diferenciación, este precursor comenzará a expresar receptores específicos para factores de crecimiento y, en cambio, perderá la expresión de moléculas de histocompatibilidad de clase II, razón por la cual un neutrófilo maduro carece de ellas. A diferencia de los neutrófilos, los monocitos, en las mismas fases de la diferenciación, sí mantienen la expresión de estas moléculas.
Los neutrófilos son células de vida media muy corta, alrededor de 2-3 días, circulan libremente por el torrente circulatorio y se extravasan mediante diapédesis a través de los endotelios en condiciones de inflamación. La presencia de infección o lesión tisular conduce a que los macrófagos liberen altas cantidades de G-CSF y GM-CSF, estimulando a la médula ósea a producir grandes cantidades de neutrófilos que son liberados al torrente sanguíneo ocasionando la consecuente neutrofilia5. El reclutamiento y extravasación a los focos de infección requiere la presencia de mediadores proinflamatorios, moléculas de adhesión y quimiocinas, esenciales en todo este proceso.
Los neutrófilos expresan altas cantidades de moléculas de adhesión como las integrinas CD11a y CD11b o la selectina CD62L, también expresan de forma constitutiva grandes cantidades de receptores Fc para la inmunoglobulina IgG, CD32 y CD64, y solo después de su activación el CD16. Una vez estimulados, emiten pseudópodos, internalizan el patógeno en una vesícula denominada fagosoma, que a su vez se unirá a los lisosomas citoplasmáticos formando el fagolisosoma. Seguidamente, se produce un conjunto de reacciones químicas con el objetivo de destruir al patógeno. Para ello disponen de dos tipos de gránulos intracelulares, primarios y secundarios. En los primarios se produce el estallido respiratorio, que consiste en la reducción del oxígeno mediante la NADPH oxidasa para dar lugar a las distintas especies oxidantes derivadas del oxígeno como el peróxido de hidrógeno, los radicales hidróxilo o el ion superóxido. En estos mismos gránulos, también existen productos tóxicos como las hidrolasas ácidas, las mieloperoxidasas y las lisozimas o, incluso, péptidos antimicrobianos como las defensinas, las catelicidinas o las proteínas inductoras de permeabilidad bacteriana. Por otro lado, presentan un tipo de gránulos exclusivos, denominados secundarios y que contienen lactoferrina y lisozima, que interfieren en el metabolismo de los patógenos y la actividad antimicrobiana, aunque también se les han asociado funciones inmunomoduladoras, antiinflamatorias, antitrombóticas y antitumorales6.
EosinófilosLos eosinófilos se localizan principalmente en el torrente sanguíneo, aunque también en las mucosas de las vías respiratorias, digestivas y genitourinarias. Su principal papel es la protección frente a infecciones originadas por parásitos, principalmente helmintos. Representan entre el 2-5% de los leucocitos sanguíneos. Presentan un núcleo bilobulado que se tiñe con colorantes ácidos (eosina). Los eosinófilos se diferencian en la médula ósea a partir del precursor común CFU-GEMM, posteriormente presenta su propia línea de diferenciación mielocítica CFU-Eo (unidad formadora de colonias del eosinófilo) y dirigida finalmente por las citocinas GM-CSF, IL-3 e IL-5 (fig. 4)7.
Los eosinófilos presentan en su membrana receptores Fc específicos de baja afinidad, tanto para la inmunoglobulina IgE como para la IgA. A diferencia de los basófilos, los eosinófilos reconocen las IgE y las IgA que recubren los parásitos para poder realizar su acción defensiva. De forma distinta a los neutrófilos, estas células no son fagocitos profesionales, sino que exocitan grandes cantidades de gránulos que contienen especies tóxicas características del mismo eosinófilo como la proteína básica principal (MBP), proteínas catiónicas del eosinófilo (ECP) o peroxidasas y neurotoxinas derivadas del eosinófilo (EDN), siendo liberadas en la superficie de patógenos no fagocitables de gran tamaño. La MBP no solo es una potente toxina contra los helmintos, sino que es capaz de desgranular a los mastocitos. En países que presentan una baja incidencia de infecciones por estos tipos de parásitos, los eosinófilos contribuyen al desarrollo de la patología alérgica8,9.
BasófilosLos basófilos se encuentran en la circulación en cantidades muy pequeñas, representando el 0,2-0,5% de los leucocitos; no obstante, en condiciones de inflamación se pueden encontrar en los tejidos. Los basófilos presentan un papel defensivo frente a los parásitos; sin embargo, junto con los mastocitos, son los principales responsables de la inducción de las respuestas inflamatorias alérgicas. Son células de vida corta. Morfológicamente, presentan el núcleo lobular e irregular y se tiñen con colorantes básicos (hematoxilina). Al igual que los neutrófilos y los eosinófilos, proceden del precursor común CFU-GEMM y posteriormente presenta su propia línea de diferenciación mielocítica CFU-B (unidad formadora de colonias del basófilo), la citoquina IL-3 es indispensable para su diferenciación (fig. 4)1,8.
Los basófilos presentan receptores Fc de alta afinidad para la inmmuglobulina IgE (Fc¿RI) que recoge cualquier IgE que se encuentre circulando, también receptores Fc de baja afinidad para IgG (FcγRII), para el complemento (CD11b, CD11c), TLR y para prostaglandinas (DP2). El entrecruzamiento o activación de dos moléculas de IgE provoca la liberación inmediata de mediadores preformados como las aminas vasoactivas, las histaminas y la serotonina. Además, libera otros mediadores derivados de las membranas como son los leucotrienos (B4, C4, D4 y E4), prostaglandinas y factores de activación plaquetaria. Todos ellos dirigidos al incremento de la permeabilidad vascular, la broncoconstricción, y la inducción de la respuesta inflamatoria con el papel de eliminar patógenos9.
MastocitosLos mastocitos, llamados clásicamente células cebadas, constituyen una de las primeras y más rápidas barreras innatas defensivas frente a la invasión de los patógenos. A diferencia de los basófilos, se encuentran preferentemente en el tejido conectivo y numerosas áreas donde exista facilidad de contacto con los patógenos como la dermis, cerca de los vasos sanguíneos, linfáticos y los nervios, mucosas y submucosas del tracto digestivo, en la conjuntiva, los alvéolos y las vías respiratorias. A diferencia de los basófilos, son células de vida larga. No presentan grandes números en nuestro organismo, sin embargo, su activación produce la liberación explosiva de moléculas tóxicas y proinflamatorias frente a los patógenos.
Los mastocitos inician la inflamación y son responsables, junto con los basófilos y los eosinófilos, de reacciones severas del sistema inmune como las reacciones alérgicas. Morfológicamente, son similares a los basófilos y al igual que los mismos se originan en la médula ósea, aunque los gránulos de histaminas son más pequeños pero se encuentran en mayor número10. Sin embargo, presentan una línea de diferenciación independiente del precursor que origina a los neutrófilos, eosinófilos y basófilos, si bien todas estas células proceden del mismo progenitor hematopoyético CD34+ y el progenitor CFU-GEMM. A este precursor se le denomina como unidad formadora de colonias de mastocitos (CFU-Mast).
Es pertinente aclarar que, durante mucho tiempo, se ha sostenido que los mastocitos representaban un estado de diferenciación tisular de los basófilos. No obstante, se ha demostrado que los mastocitos tienen una línea de diferenciación distinta a los basófilos, si bien toda la línea de diferenciación no es del todo bien conocida. En concreto, los mastocitos proceden de un precursor que expresa CD34, CD13 y expresa el C-Kit (CD117), pero no expresa el receptor FC¿RI11. A diferencia del resto de células de la línea mieloide, el CD117 no desaparece durante su maduración, aunque sí pierde la expresión del CD34 y, en muchas ocasiones, la del CD13. La maduración de los mastocitos ocurre fuera de la médula ósea12, adquiriendo su fenotipo característico acorde a su estado de maduración y activación en consecuencia con el microambiente del tejido donde se van a localizar, mientras conservan su capacidad proliferativa. El papel del stem cell factor (SCF), liberado por las células estromales residentes en la médula ósea, es crítico en la proliferación, diferenciación y activación de los mastocitos mediante la estimulación a través del receptor cKit, previniendo a su vez la apoptosis y favoreciendo la adhesión a la fibronectina estructural.
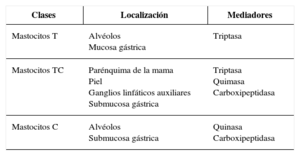
Existen diferentes tipos de mastocitos maduros en función de su localización en los tejidos y de los mediadores que contienen. Los mastocitos T, que solo presentan en su interior triptasa y se encuentran principalmente localizados en los alvéolos y la mucosa gástrica. Los mastocitos TC presentan triptasa, quimasa (serinproteasas) y carboxipeptidasa, y están localizados en tejidos como el parénquima de la mama, en la piel, en los ganglios linfáticos axilares y en la submucosa gástrica. Por último, los mastocitos C, que solo contienen quimasa y carboxipeptidasa, son los menos frecuentes, y se localizan en los alvéolos y en la submucosa gástrica (tabla 1).
Clases de mastocitos en función de su distribución y los mediadores que contienen
| Clases | Localización | Mediadores |
|---|---|---|
| Mastocitos T | Alvéolos Mucosa gástrica | Triptasa |
| Mastocitos TC | Parénquima de la mama Piel Ganglios linfáticos auxiliares Submucosa gástrica | Triptasa Quimasa Carboxipeptidasa |
| Mastocitos C | Alvéolos Submucosa gástrica | Quinasa Carboxipeptidasa |
Los mastocitos expresan en su superficie miles de inmunoglobulinas de la clase IgE, todas específicamente diferentes, unidas mediante su receptor Fc Fc¿RI. La señalización mediante su antígeno, utilizando dos IgE (igual que en los basófilos), produce una transducción de señal intracelular que termina con la liberación de los mediadores preformados contenidos en sus gránulos intracelulares e inicia la señalización para sintetizar más. Entre los mediadores liberados se encuentran productos activadores del complemento, citocinas y otros componentes moleculares proinflamatorios. Los mastocitos, a su vez, son activados mediante las anafilotoxinas C3a y C3b a través de los receptores C3aR y C5aR, el factor de crecimiento nervioso (NGF) vía el receptor TrKA (receptor de tropomiosina kinasa A), vía IgG y sus receptores FcγIgR, y mediante receptores de tipo toll13. En los últimos años, se ha demostrado que la regulación en la activación del mastocito es más compleja de lo que parecía y, como en la mayoría de las células, se necesita de un equilibrio entre señales positivas y negativas intracelulares para realizar su función. Entre estas señales reguladoras tenemos secuencias ITAM, enzimas quinasas y fosfatasas, moléculas adaptadoras, lípidos y lipasas o el gp-49B1-aVB314. Además, se ha comunicado que tanto los mastocitos como los granulocitos, en general, y al igual que las células dendríticas, presentan un relevante papel en la transición entre la inmunidad innata y la adaptativa9.
Monocitos y macrófagosLos monocitos circulantes de sangre periférica representan entre el 5-10% de los leucocitos. Constituyen una población leucocitaria heterogénea con la función de iniciar la inflamación y la eliminación directa de microorganismos patogénicos. Se encuentran vigilando el tejido vascular o permaneciendo infiltrados en los tejidos periféricos ante una posible invasión microbiana. Son críticos en la eliminación de bacterias, hongos y parásitos15. Morfológicamente presentan un núcleo bilobulado y arriñonado que ocupa dos tercios de la célula y la define como célula mononuclear. Se originan en la médula ósea y derivan de las células hematopoyéticas pluripotenciales que produce la línea mieloide (CFU-GEMM). Seguidamente se diferencian en las CFU-GM, que se comprometerán a un precursor monocitario común que producirá monoblastos proliferantes, promonocitos y monocitos finalmente, que a su vez podrán diferenciarse en los tejidos a macrófagos e, incluso, ante la presencia de ciertas citocinas, IL-4 y GM-CSF, a células dendríticas16. Las citocinas esenciales para su diferenciación son el M-CSF, GM-CSF y la IL-3. Al terminar su diferenciación en la médula ósea, serán liberados al torrente circulatorio donde permanecerán poco tiempo, desde unas pocas horas (6-8) hasta un máximo de tres días17.
Los monocitos se caracterizan por la expresión del CD115, el receptor del M-CSF y el CD11b. Se clasifican en diferentes subpoblaciones funcionales atendiendo a la expresión de receptores Fc, quimiorreceptores, moléculas de adhesión y patrones de reconocimiento, todo ello relacionado con su velocidad de extravasación, su capacidad fagocítica y la cantidad o tipo de citoquinas producidas. En la actualidad, los monocitos se clasifican en función de la expresión del receptor de lipopolisacárido bacteriano (LPS) CD14, el receptor Fc CD16 (receptor de baja afinidad para la IgG, FcγRIII), la expresión de los quimiorreceptores CCR2, CX3CR1, y la molécula de adhesión CD62L. Utilizando estos antígenos de superficie, los monocitos presentes en la circulación sanguínea se pueden dividir en tres subpoblaciones sanguíneas funcionalmente diferentes: monocitos clásicos (CD14+CD16-), inflamatorios (CD14+CD16+CCR2+) y reguladores (CD14-/dimCD16+)17. Los primeros se encargarían de la eliminación de los patógenos, los segundos de los procesos inflamatorios y los terceros de la inmunomodulación positiva o negativa del sistema inmune. El estudio de la distribución de estas subpoblaciones en la sangre periférica ha aportado evidencias fisiopatológicas asociadas a diferentes patrones de alteración en los procesos inflamatorios de diferentes patogenias y/o etiologías (tabla 2)18.
Subpoblaciones de monocitos en función de la expresión de antígenos de superficie CD14 y CD16
| Clases de monocitos | Fenotipo | Función principal |
|---|---|---|
| Clásicos | CD14+CD16– | Eliminación de patógenos |
| Transicionales/inflamatorios | CD14+CD16+CCR2–/+ | Extravasación/inflamación |
| Reguladores | CD14dimCD16+ | Inmunomodulación |
Los monocitos son células incapaces de replicarse en la sangre periférica o en ausencia de inflamación19. Sin embargo, y al cabo de un tiempo recirculando, los monocitos se extravasan a los tejidos, donde pueden proceder a diferenciarse a diferentes tipos celulares dependiendo del tejido y del ambiente molecular en el que se encuentren. De esta manera, se pueden diferenciar a tipos celulares morfológicamente diferentes y con funciones claramente distintas como, por ejemplo, macrófagos tisulares, macrófagos alveolares, macrófagos deciduales, células de Kupffer, células de microglía o en células dendríticas, entre otras, todas ellas con diferentes funciones efectoras y capacidades individuales20. Esta capacidad de los monocitos sanguíneos de diferenciarse a célula dendrítica es muy relevante, ya que está siendo ampliamente utilizada por los investigadores para realizar ensayos de inmunoterapia. Monocitos y macrófagos actúan insitu en los tejidos, presentan en su superficie una gran cantidad de receptores capaces de detectar microorganismos, lípidos e incluso restos de células muertas. Una vez activados, su vida media es muy corta, pero son capaces de producir inmediatamente grandes cantidades de especies reactivas del óxigeno (ROS), prostaglandinas y citoquinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α), IL-1β, IL-6, CXCL8, IL-10 o vEGF.
Los macrófagos, en general, representan el estado de diferenciación final de los monocitos. Morfológicamente, son más grandes que los monocitos debido a la presencia de un retículo endoplasmático rugoso muy desarrollado y de un alto número de mitocondrias, además se caracterizan por una vida media larga en los diferentes tejidos que los contienen (conectivos, pulmonares, hepáticos…). En estado inactivo, se encuentran «patrullando» por los tejidos no inflamados en busca de patógenos y restos celulares, conservando en todo momento una alta capacidad fagocítica; sin embargo, su capacidad de procesar antígenos permanece inactiva. Mediante sus receptores de superficie, principalmente TLR, reconocen patrones moleculares asociados a los patógenos (PAMP). De esta manera reconocen a los patógenos, se activan y liberan grandes cantidades de las citoquinas antes mencionadas, como el TNF-α, IL1β o IL-8, imprescindibles para iniciar la inflamación y el reclutamiento celular. La activación de los macrófagos también tiene como principal objetivo destruir a los microorganismos patogénicos. Mediante una fagocitosis mediada por receptor, internaliza los patógenos en compartimentos vesiculares intracelulares donde serán destruidos e hidrolizados en fragmentos compuestos por unos pocos aminoácidos que serán posteriormente incorporados a las moléculas de histocompatibilidad de clase II21. Además, los monocitos y macrófagos tienen un papel crítico en el desarrollo de tejidos, la homeostasis y la reparación de lesiones, participando en la orientación de la remodelación vascular, la estimulación de las células madre y progenitoras locales, y la reparación estructural de los tejidos tales como músculo y hueso. Consecuentemente, se han descrito dos tipos de macrófagos diferentes acorde a su función y su capacidad de secretar citocinas proinflamatorias o antiinflamatorias, los macrófagos M1 y los M2. Los macrófagos M1 se producirían en presencia de señales inflamatorias como el interferón gamma (IFN-γ) y el TNF-α, mientras que los M2 en presencia de citocinas antiinflamatorias como la IL-1022. Los primeros presentarían un papel antibacteriano, antivírico y antitumoral, secretando citocinas como el TNF-α, IL1-β, IL-6 e IL-12; los segundos suprimirían la respuesta inmune e intervendrían en la reparación del daño y regeneración tisular, secretando IL-10, TGF-β, VEGF y metaloproteinasas (MMP)23.
La división del trabajo en dos subpoblaciones sugiere un mejor aprovechamiento en las funciones defensivas y en las regenerativas. Sin embargo, parece que estas células M1/M2 están en un complejo equilibrio. El inadecuado balance de estos macrófagos está estudiándose en la actualidad, participando en patologías neoplásicas, la obesidad o enfermedades autoinmunes como la artritis reumatoide, la enfermedad de Crohn y la esclerosis múltiple24.
Células dendríticasLas células dendríticas representan apenas entre el 0,2-0,5% de los leucocitos sanguíneos circulantes; sin embargo, se encuentran mayoritariamente en los tejidos de nuestro organismo, esencialmente debajo de la piel y de todas nuestras mucosas, en el parénquima de los órganos y en los tejidos linfáticos7. Presentan un aspecto morfológico arborescente con largas prolongaciones de la membrana, similar a las dendritas de las neuronas, de ahí su nombre. Su función principal consiste en enlazar el sistema inmune innato con el sistema inmune adaptativo. A diferencia de los monocitos, son células encargadas de detectar patógenos, procesarlos y trasladarse a los órganos linfoides secundarios más cercanos para presentar los antígenos. Aquí se encargarán de activar a los linfocitos T y dirigirles en su diferenciación hacia la respuesta defensiva más adecuada25. Pero, además, estas células exhiben una relevante y crucial función inmunorreguladora. No solo activan o desactivan al sistema inmune, además están implicadas en el establecimiento de los procesos de tolerancia central y periférica regulando de esta forma la autorreactividad y la autoinmunidad. Se originan en la médula ósea y presentan la misma vía de diferenciación que los monocitos, derivando de la línea mieloide CFU-GEMM, la CFU-GM para acabar en una célula precursora monocitaria que decidirá, en presencia de IL-4 y GM-CSF, diferenciarse a célula dendrítica en vez de a monocito, pero nunca a granulocito16 (fig. 4).
En este tipo celular reside la clave para comprender el paradigma de cómo asegurar nuestra supervivencia utilizando un sistema inmune innato basado en el reconocimiento de patrones moleculares asociados a patógenos (PAMP) mediante unos pocos receptores muy conservados y hereditarios. Un sistema así tendería a fracasar en la coevolución con los microorganismos patógenos, ya que estos han demostrado una gran capacidad para adaptarse y evadir a nuestro sistema defensivo. Surge entonces este tipo celular que presenta la propiedad de explorar exhaustivamente el medio que le rodea mediante un proceso denominado macropinocitosis. Este proceso, unido a la activación de sus receptores de membrana, les permite diferenciarse y dirigir la respuesta inmunitaria específica frente a los patógenos, aunque estos muten o evolucionen.
Las primeras células dendríticas descubiertas fueron las células de Langerhans en 1968. Su forma arborescente con prolongaciones se asemeja mucho a la de las células dendríticas descubiertas cinco años más tarde. Su papel fue desconocido durante muchos años, pero Steinman en los años 70 fue el primero en asociarlas a un nuevo linaje celular llamado células dendríticas y cuya función principal era el reconocimiento de antígenos en diferentes zonas anatómicas de nuestro organismo26. Desde entonces, se les han dado diferentes nombres y propiedades en función del tejido donde estaban presentes, en función de su estado de activación, o en función de los precursores de los cuales derivan. A continuación, describiremos brevemente las subpoblaciones de células dendríticas en función de estos tres criterios, los cuales son utilizados indistintamente.
Tipos de células dendríticas en función de la histologíaEn función del tejido donde se hallan nos encontramos con las siguientes células dendríticas (tabla 3):
- 1.
Las células dendríticas presentes en el tejido linfoide, en médula ósea, timo y en la zona marginal del bazo se denominan células interdigitantes.
- 2.
A las células dendríticas, fuera de los órganos linfoides y presentes en la epidermis y en las mucosas se les denomina células de Langerhans.
- 3.
A las células dendríticas fuera de los órganos linfoides y presentes en tejidos como el riñón, el corazón y el pulmón se les denomina células intersticiales.
- 4.
Las células dendríticas presentes en las vías aferentes linfáticas dirigidas hacía los órganos linfoides secundarios se denominan células veladas.
- 5.
Las células dendríticas presentes en la sangre «células dendríticas sanguíneas» son denominadas células dendríticas mieloides o plasmacitoides.
Tipos de células dendríticas en función de criterios histológicos, estado de activación y origen
| Histología | Distribución |
|---|---|
| C. interdigitantes | Tejido linfoide Médula ósea Timo Zona marginal del bazo |
| C. Langerhans | Epidermis Mucosas |
| C. intersticiales | Riñón, corazón y pulmón |
| C. veladas | Vías aferentes linfáticas |
| C. sanguíneas | Sangre |
| Estado de activación | Características |
| iDC (células dendríticas inmaduras) | Estado inactivo Incorporación y procesamiento de patógenos Mantienen la tolerancia |
| mDC (células dendríticas maduras) | Adquieren dendritas Producen grandes cantidades de citoquinas como IL-12, IFN-α e IL-10 |
| Origen | Lugar de procedencia | Lugar de migración | Características |
| C. Langerhans | Médula ósea | Epidermis | Reconocimiento de antígenos presentados mediante MHCII a LT |
| C. Folicular | Estroma o mesénquima | OLS | *No son capaces de procesar antígenos y presentarlos a MHCII *Retienen inmunocomplejos mediante receptores Fc y del complemento |
| MDC | Médula ósea (mieloide) | Sangre, tejidos y órganos linfoides secundarios | Enlace entre la respuesta innata y la adaptativa Subtipos: MDC1 y MDC2 |
| PDC | Médula ósea (linfoide) | Sangre o tejidos | Función antivírica |
IFN: interferón; MDC: células dendríticas de origen mieloide; OLS: órganos linfoides secundarios; PDC: células dendríticas de origen linfoide.
Las células dendríticas son sintetizadas y liberadas a los tejidos donde permanecen en un estado estacionario o inactivo, y son denominadas células dendríticas inmaduras (iDC). Esta terminología incluye todas las células dendríticas antes mencionadas. Funcionalmente son células muy eficientes en la incorporación (sea por fagocitosis o pinocitosis) y el procesamiento de patógenos, expresan un número bajo de moléculas de histocompatibilidad de clase II, de moléculas implicadas en la coestimulación (CD40, CD54, CD58, CD80 y CD86) y son capaces de mantener la tolerancia presentando continuamente antígenos propios a los linfocitos T.
La activación de las células dendríticas, ya sea mediante sus receptores de superficie (TLR) o mediante señales intracelulares derivadas del procesamiento de los patógenos (se hace referencia a ellos en profundidad en la actualización de respuestas innatas y adaptativas de esta unidad temática) produce su diferenciación a células dendríticas maduras (mDC). Morfológicamente se diferencian adquiriendo dendritas, aumentan mucho la expresión de moléculas de histocompatibilidad de clase I y II, la expresión de moléculas de coestimulación (CD40, CD54/ICAM-1, CD58/lFA-3, CD80 y CD86) y el CD83 (marcador de activación de células dendríticas) y son capaces de producir grandes cantidades de citoquinas como la IL-12, IFN-α e incluso IL-10 (tabla 3).
Tipos de células dendríticas en función de su origenActualmente, todos los autores están de acuerdo en que las células dendríticas tienen un origen común en la médula ósea, como hemos comentado previamente. Las células dendríticas se caracterizan por expresar el marcador CD209 (DC-SIGN) y ser negativas o expresar débilmente el CD14, el antígeno de superficie característico de los monocitos27. Sin embargo, no todas las células dendríticas proceden directamente de la médula ósea. Desde el año 1998 se conoce la propiedad que tienen los monocitos circulantes de diferenciarse a células dendríticas o a células de Langerhans, lo que implica una diferenciación secundaria o indirecta. El estudio de las células de Langerhans ha sido intenso hasta reconocer que se trata de un tipo de célula dendrítica que se origina en la médula ósea, migra a la epidermis situándose en el epitelio escamoso donde reconocerá antígenos y se los presentará en moléculas de histocompatibilidad de clase II a los linfocitos T28.
Por otro lado, existe un tipo celular denominado célula dendrítica folicular, esta se encuentra en los órganos linfoides secundarios; sin embargo, no son células dendríticas, ya que no tienen el mismo origen que es estromal o mesenquimal, y no son capaces de procesar antígenos y presentarlos en moléculas de clase II, por lo que no son células presentadoras de antígeno profesionales. Sin embargo, son capaces de retener inmunocomplejos mediante receptores Fc y receptores del complemento que presentan en su superficie29.
Por último, se han diferenciado distintas subpoblaciones sanguíneas de células dendríticas procedentes de la médula ósea en función del precursor que las ha generado. De esta manera, las células dendríticas presentes en sangre periférica se diferencian en dos grandes grupos: las células dendríticas de origen mieloide (MDC) y las células dendríticas de origen linfoide (PDC).
Las MDC son células que derivan de la estirpe mieloide y se caracterizan por expresar el CD33 en alta intensidad. Se localizan en la sangre, tejidos y órganos linfoides secundarios expresando CD11c en alta intensidad y no expresando el CD123. Presentan una vida media corta, y se renuevan muy rápidamente. Las MDC secretan IL-12, IL-8 y TNF-α pero no IFN-α, por esto se les asigna la función de enlace entre la respuesta innata y la respuesta adaptativa. Además, dentro de las MDC se han caracterizado, al menos, dos subpoblaciones celulares: las células dendríticas mieloides de tipo I (MDC1) y las células dendríticas mieloides de tipo II (MDC2). Las MDC1 son las más abundantes (0,2% de los leucocitos circulantes) y se diferencian de las MDC2 (muy minoritarias con menos del 0,05%) porque son capaces de expresar el CD1c30. El CD1 representa una familia de moléculas de histocompatibilidad no clásica encargada de la presentación de antígenos lipídicos.
Las MDC-1 muestran altos niveles de HLA-DR y de CD11c, mientras que las MDC-2 presentan niveles más bajos de ambos marcadores de superficie, pero a diferencia de las MDC-1 expresan el CD141. Las MDC-1 presentan altos niveles de TLR-2, 6 y 9, mientras que las MDC-2 expresan altos niveles de TLR-3. Esta diferencia está directamente asociada con sus diferentes propiedades efectoras. De esta manera, las MDC-1 pueden producir IL-12 y altos niveles de IL-8, MIP-1α acompañado de IL-6, IL1β y otras importantes citocinas proinflamatorias, promoviendo el reclutamiento de granulocitos, monocitos y linfocitos al foco de la inflamación. Al activarse y diferenciarse a célula dendrítica madura no pierde la secreción de IL-12, pudiendo inducir respuestas de tipo Th1. En cambio, las MDC-2 también pueden producir IL-12, IL6 e IL8 en grandes cantidades, además de IFN-β e IP-10, y cuando se activan pueden perder la secreción de la IL-12 adquiriendo la capacidad de sintetizar IL-10 y aumentando en su superficie los niveles de expresión de los receptores inmunes inhibidores (familia ILT). Funcionalmente, podrían colaborar también en la diferenciación hacia respuestas linfocitarias tipo Th2 y regulando la presentación de antígenos propios, presentando un relevante papel antiinflamatorio. Estudios recientes demuestran que las MDC-1 también podrían producir IL-10 y receptores del tipo ILT, interviniendo en la tolerancia del sistema31–35. Algunos investigadores sugieren la presencia de una tercera población de mDCs, caracterizada por la expresión del CD16, pero que no expresarían ni CD1c ni CD141 y que secretaría grandes cantidades de TNF-α, estando especializadas en la inflamación y cooperación con los linfocitos T, en vez de la migración como las MDC-132,35.
Las PDC (representan el 0,2%), a diferencia de las MDC, derivan de la estirpe linfoide y no expresan o lo hacen levemente el antígeno de superficie CD33. Se localizan en sangre o tejidos y expresan el antígeno de superficie CD123, pero no el CD11c o en muy baja intensidad de expresión. Son células dendríticas con una vida media larga y, por lo tanto, se renuevan lentamente. Las PDC producen altas cantidades de IFN-α y por esto se le atribuye la función antivírica. Otra de las características que diferencia a las PDC de las MDC se establece en que las PDC se extravasan tanto a tejidos residentes como recirculan a través de las vénulas endoteliales altas por los órganos linfoides secundarios, mientras que las MDC se extravasarían a los tejidos, y de ahí migrarían mediante vías linfáticas aferentes a los órganos linfoides secundarios30 (tabla 3).
Linfocitos natural killerLas células NK representan uno de los componentes celulares especializados más relevantes de nuestro sistema inmune, caracterizándose por presentar capacidades citotóxicas e inmunorreguladoras. Las células NK están implicadas en la primera línea de defensa frente a infecciones víricas, bacterias intracelulares y la eliminación de células neoplásicas, estando también involucradas en la patología de la autoinmunidad, las inmunodeficiencias o los trasplantes. De hecho, su denominación de NK o células citotóxicas naturales se debe a la observación inicial de ser capaces de eliminar células tumorales de forma espontánea36, sin inmunización previa, es decir, células cuyo papel efector no estaba restricto por la presentación antigénica en el contexto de determinadas moléculas de histocompatibilidad clásicas de clase I o II.
Representan entre el 5-15% de los linfocitos sanguíneos circulantes; sin embargo, también se las puede localizar como células centinelas debajo de la piel, mucosas, médula ósea y abundantemente en el bazo. Morfológicamente, las células NK han sido definidas como linfocitos granulares grandes, debido a su mayor tamaño respecto de los linfocitos T, con los cuales comparten receptores de superficie y funciones37. Su citoplasma se caracteriza por la presencia de gránulos azurófilos. Las células NK proceden de la diferenciación de precursores presentes en médula ósea, timo e hígado y que son comunes a los linfocitos T. A diferencia del resto de componentes celulares del sistema inmune innato, y a excepción de las células dendríticas plasmacitoides, proceden de la línea de diferenciación linfoide, que a su vez procede de las células madre CD34+. Se ha demostrado que la interleucina IL-15 es esencial para que los precursores CD34+ procedentes del cordón umbilical, médula ósea o timo se diferencien a linfocitos NK38. Durante este proceso de diferenciación, las células NK deben de adquirir muy rápidamente competencias para reconocer las moléculas de histocompatibilidad autólogas, seleccionándolas adecuadamente mediante la expresión de una serie de receptores característicos denominados receptores inhibidores. De esta manera, se logra el aprendizaje necesario para reconocer las estructuras celulares propias, y evitar la eliminación espontánea de las células estromales adyacentes, esenciales en su propia diferenciación, momento crítico en el que la célula NK madura y adquiere sus propiedades citolíticas efectoras. Receptores como el CD244 son importantes en este proceso de maduración y no agresión por parte de los linfocitos NK39.
Los linfocitos NK, y de manera similar a los linfocitos T, secretan citoquinas proinflamatorias, antiinflamatorias y presentan mecanismos efectores comunes que incluyen la liberación de moléculas citotóxicas como las perforinas y granzimas o la expresión del receptor de superficie CD95 (FAS) capaces de inducir la lisis y la apoptosis celular en células diana. Sin embargo, las NK presentan importantes diferencias respecto de los linfocitos T, en primer lugar no expresan TCR (el receptor clonal característico de los linfocitos T) ni realizan, por tanto, la recombinación somática (sintetizan CD3, pero no lo expresan en superficie). Tampoco necesitan la maduración en el timo, imprescindible para el desarrollo de los linfocitos T.
Los linfocitos NK no solo eliminan células anómalas o infectadas, sino que también se encargan de diferenciar entre células autólogas y las heterólogas o xenogénicas, siendo en parte las principales responsables del rechazo en los trasplantes. Este proceso lo realizan eficientemente gracias a un conjunto de receptores cada vez mejor conocidos. Estos receptores se han clasificado en dos grandes familias, la de los receptores activadores y la de los receptores inhibidores. Esta última se conoce desde hace tiempo, siendo responsables del reconocimiento de lo «propio» examinando las moléculas de histocompatibilidad de clase I. De los receptores activadores conocemos cada vez más y, sin embargo, poco sabemos de sus ligandos, foco actual de interés para los investigadores.
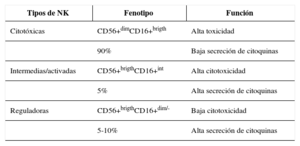
Al igual que el resto de las células del sistema inmune, no existe un solo tipo de linfocito NK. Intentar definir las subpoblaciones de células NK en función de la expresión de sus receptores es muy complicado y, por lo tanto, las deberíamos clasificar como células heterogéneas. Sin embargo, durante años se han identificado clases de células NK dependiendo de las funciones que eran capaces de realizar, su capacidad lítica o de liberar citocinas asociada a la expresión de receptores de superficie. Las células NK se caracterizan por la expresión del CD56 y la ausencia del CD3. A continuación se han clasificado las células NK en tres subpoblaciones en base a la intensidad de expresión de los antígenos de superficie CD56 y CD16, junto con el estudio de su capacidad efectora citotóxica. En la actualidad, se están estudiando también subpoblaciones de células NK asociadas a la expresión del CD62L, CD57, CD38, CD69. En función de la expresión de los antígenos de superficie CD56 y el CD16 se encuentran las células NK CD56+dimCD16+brigth que representarían un 90% del total de las NK circulantes en sangre, y se les denomina NK citotóxicas debido a su alta capacidad lítica y su baja capacidad de secretar citoquinas. Las CD56+brightCD16+dim/– representarían entre el 5-10% y se caracterizarían por su baja capacidad citotóxica y su alta capacidad inmunorreguladora, siendo responsables de la liberación de altas cantidades de citoquinas proinflamatorias y antiinflamatorias. Por último, un estado intermedio de diferenciación CD56+brightCD16+int capaz de presentar alta capacidad citotóxica y de secretar citocinas40 (tabla 4).
Subpoblaciones de células natural killer en función de los antígenos de superficie CD56 y CD16
| Tipos de NK | Fenotipo | Función |
|---|---|---|
| Citotóxicas | CD56+dimCD16+brigth | Alta toxicidad |
| 90% | Baja secreción de citoquinas | |
| Intermedias/activadas | CD56+brigthCD16+int | Alta citotoxicidad |
| 5% | Alta secreción de citoquinas | |
| Reguladoras | CD56+brigthCD16+dim/- | Baja citotoxicidad |
| 5-10% | Alta secreción de citoquinas |
Los autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Importante
Muy importante
Metaanálisis
Artículo de revisión
Ensayo clínico controlado
Guía de práctica clínica
Epidemiología
-
 Importante
Importante
-
 Muy importante
Muy importante
-
 Metaanálisis
Metaanálisis
-
 Ensayo clínico controlado
Ensayo clínico controlado
-
 Epidemiología
Epidemiología
-
 Artículo de revisión
Artículo de revisión
-
 Guía de práctica clínica
Guía de práctica clínica