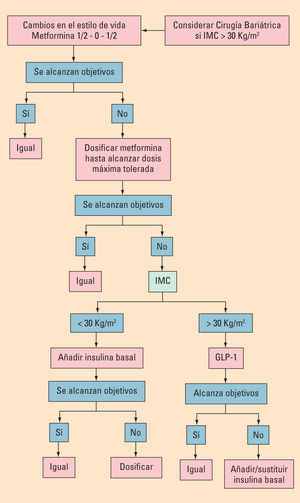
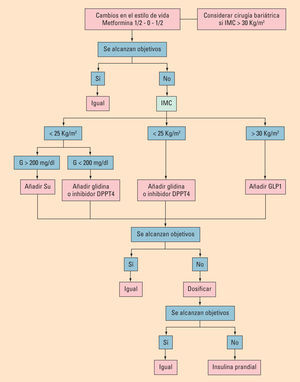
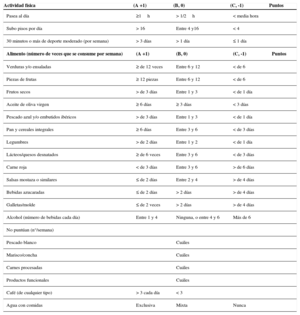
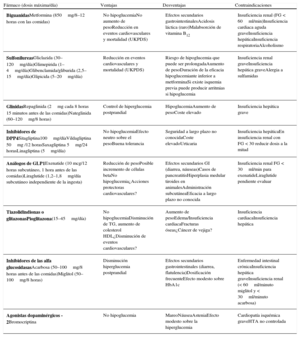
La prevalencia de la diabetes mellitus continúa aumentando de forma alarmante. El manejo de la diabetes se ha ido volviendo más complejo en los últimos años con la incorporación de varios fármacos orales nuevos que amplían mucho las posibilidades terapéuticas. Parece claro que la metformina es el primer fármaco que se recomienda utilizar, inicialmente en dosis bajas, simultáneamente a inducir cambios en el estilo de vida. Sin embargo, existe poca evidencia acerca de las mejores combinaciones a utilizar y por eso las recomendaciones de las guías de práctica clínica cada vez son menos prescriptivas. La tendencia en el momento actual es recomendar un tratamiento individualizado para cada paciente, basado en su estilo de vida y hábitos, su edad, peso corporal y estado evolutivo de la enfermedad, siendo ésta la clave del éxito para obtener unos buenos resultados.
Palabras clave
Prevalence of diabetes mellitus continues to increase at an alarming rate. Management of diabetes has become more complex in recent years with the incorporation of several new oral drugs that greatly increase the therapeutic possibilities. It seems clear that metformin is the first drug whose use is recommended, initially at low doses, while simultaneously inducing changes in the style of life. However, there is little evidence on the best combinations to use and thus the recommendations of the clinical practice guidelines are increasingly less prescribed. The current tendency is to recommend an individualized treatment for each patient, based on their style of life and habits, age, body weight and evolutive state of the disease, this being the key to success to obtain some good results.
Keywords
Identifíquese
¿Aún no es suscriptor de la revista?
Comprar el acceso al artículo
Comprando el artículo el pdf del mismo podrá ser descargado
Teléfono para incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h