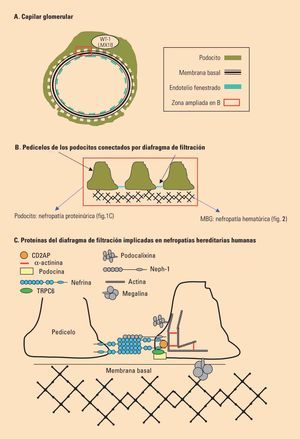
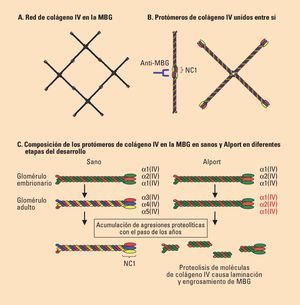
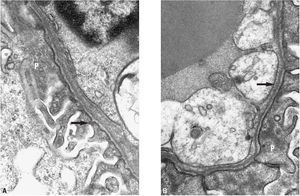
Fig. 2
Patogenia del síndrome de Alport. A. Visión esquemática de la red del colágeno IV. No están representados los enlaces disulfuro que se producen entre las cadenas. B. Para formar la red las moléculas de colágeno IV contactan entre los dominios NC1 (dominio no colágeno) y entre las colas. Los dominios NC1 son antigénicos y constituyen el antígeno reconocido por los anticuerpos anti-membrana basal glomerular (anti-MBG) que causan el síndrome de Goodpasture. Cuando un riñón sano es trasplantado a un paciente con Alport, el sistema inmune reconoce este antígeno como extraño, por lo que los riñones trasplantados pueden sufrir una enfermedad por anticuerpos anti-MBG. C. El colágeno IV de la MBG embrionaria y en el adulto. La MBG embrionaria tiene una triple hélice formada por dos cadenas a1(IV) y una cadena α2(IV). En el adulto sano el colágeno IV de la MBG contiene una cadena α3(IV), una α4(IV) y una α5(IV). En el síndrome de Alport la ausencia de una de estas tres cadenas impide la formación de la triple hélice del adulto y persiste la composición embrionaria del colágeno IV (en letras rojas el patrón patológico de composición de las cadenas). Esto confiere una mayor sensibilidad a la degradación por proteasas cuyas consecuencias se manifiestan al cabo de los años como laminación de la MBG y, tras intentos de reparación, engrosamiento. Por cortesía de Alejandro Ortiz.