Infections caused by bacteria of the Borrelia type: Lyme disease and recurrent fever
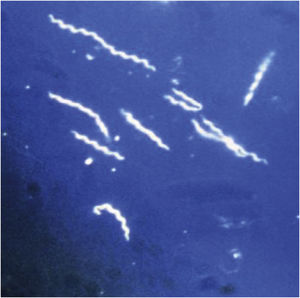
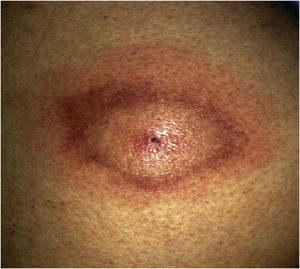
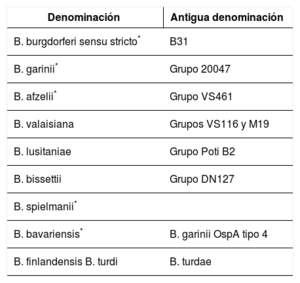
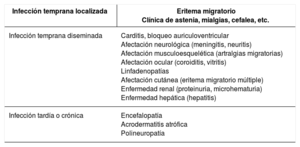
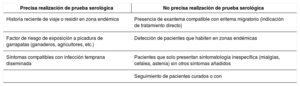
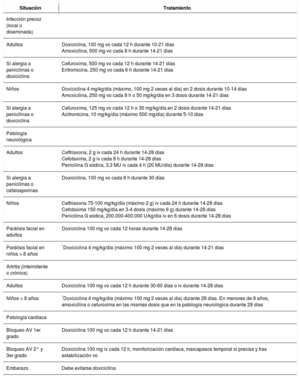
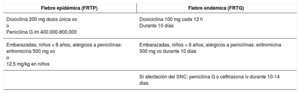
Lyme disease is a zoonotic disease transmitted by ticks and caused by Borrelia burgdorferi sensu lato. The main characteristic is a skin lesion called erythema migrans and varied systemic symptoms that develop in stages over months or years. Diagnosis is principally clinical and serological. Doxicycline is the main treatment; beta lactam antibiotics can be included as an alternative such as penicillin and cephalosporins. The prognosis is favourable after appropriate treatment. Recurrent fever is caused by various species of Borrelia. The two main forms are epidemic (transmitted by lice) and endemic (white ticks). From a clinical perspective, it is characterised by cycles of fever and apyrexia. Tetracyclines are the standard treatment.
Keywords
Palabras clave
La enfermedad de Lyme es una zoonosis transmitida por garrapatas y provocada por Borrelia burgdorferi sensu lato. La característica principal es la lesión cutánea denominada eritema migratorio y una variada sintomatología sistémica que evoluciona en fases durante meses o años. El diagnóstico es principalmente clínico y serológico. El tratamiento principal se realiza con doxiciclina, como alternativa se incluyen los betalactámicos como penicilinas y cefalosporinas. El pronóstico tras un tratamiento adecuado es favorable. La fiebre recurrente está producida por diversas especies de Borrelia. Las dos formas principales son la epidémica (transmitida por piojos) y la forma endémica (garrapatas blancas). Desde el punto de vista clínico, se caracteriza por ciclos de fiebre y apirexia. El tratamiento de elección son las tetracicilinas.
Identifíquese
¿Aún no es suscriptor de la revista?
Comprar el acceso al artículo
Comprando el artículo el pdf del mismo podrá ser descargado
Teléfono para incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h